题目内容
A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有4个电子.
(1)D原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键.
(2)当n=2时,B的原子结构示意图为 ,B与C形成的晶体属于 晶体.当n=3时,B与C形成的晶体属于 晶体.
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的电负性由大到小的顺序是 (用元素符号表示).
(4)C和D的最简单氢化物相比较:稳定性: (填化学式,下同);
沸点: 原因是 .
(1)D原子的电子排布式为
(2)当n=2时,B的原子结构示意图为
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是
(4)C和D的最简单氢化物相比较:稳定性:
沸点:
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P亚层中有4个电子,则D元素原子电子排布式为1s22s22p6 3s23p4,故D为S元素,
(1)S原子核外电子数为16,根据核外电子排布规律书写;
若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键;
(2)当n=2时,B为碳元素,原子有2个电子层,各层电子数为2、4.碳元素与氧元素生成的化合物为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,碳原子与氧原子之间形成共价键;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,周期数=电子层数、族序数=最外层电子数;
B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右电负性呈增大趋势、同主族元素从上到下电负性逐渐减弱;
(4)O的非金属性较强,形成的共价键较稳定,且可形成氢键.
(1)S原子核外电子数为16,根据核外电子排布规律书写;
若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键;
(2)当n=2时,B为碳元素,原子有2个电子层,各层电子数为2、4.碳元素与氧元素生成的化合物为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,碳原子与氧原子之间形成共价键;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,周期数=电子层数、族序数=最外层电子数;
B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右电负性呈增大趋势、同主族元素从上到下电负性逐渐减弱;
(4)O的非金属性较强,形成的共价键较稳定,且可形成氢键.
解答:
解:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P亚层中有4个电子,则D元素原子电子排布式为1s22s22p6 3s23p4,故D为S元素,
(1)S原子核外电子数为16,电子排布式为1s22s22p63s23p4,若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键,属于σ键,故答案为:1s22s22p63s23p4;σ;
(2)当n=2时,B为碳元素,原子有2个电子层,各层电子数为2、4,原子结构示意图为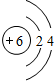 ,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,
故答案为: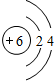 ;分子;原子;
;分子;原子;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,处于第二周期ⅠA族.
B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右电负性呈增大趋势、同主族元素从上到下电负性逐渐减弱,则电负性O>S>Si>Li,
故答案为:第2周期IA族;O>S>Si>Li;
(4)O的非金属性较强,形成的共价键较稳定,对应的氢化物的稳定性较强,且可形成氢键,沸点较高,
故答案为:H20>H2S;H20>H2S;水分子间存在氢键.
(1)S原子核外电子数为16,电子排布式为1s22s22p63s23p4,若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键,属于σ键,故答案为:1s22s22p63s23p4;σ;
(2)当n=2时,B为碳元素,原子有2个电子层,各层电子数为2、4,原子结构示意图为
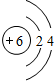 ,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,
故答案为:
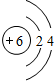 ;分子;原子;
;分子;原子;(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,处于第二周期ⅠA族.
B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右电负性呈增大趋势、同主族元素从上到下电负性逐渐减弱,则电负性O>S>Si>Li,
故答案为:第2周期IA族;O>S>Si>Li;
(4)O的非金属性较强,形成的共价键较稳定,对应的氢化物的稳定性较强,且可形成氢键,沸点较高,
故答案为:H20>H2S;H20>H2S;水分子间存在氢键.
点评:本题考查结构性质位置关系、核外电子排布规律、常用化学用语、元素周期律等,为高频考点,侧重于学生的分析能力的考查,难度中等,注意基础知识的理解掌握.

练习册系列答案
相关题目
铁和氧化铁的混合物共x mol,加盐酸后固体全部溶解,共收集到ymol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为( )
A、
| ||
| B、(x-y)mol | ||
C、
| ||
| D、(x+y)mol |
X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如下表.已知X元素最低负化合价的绝对值与其原子最外层电子数相等,Y是地壳中含量最多的金属元素.下列说法错误的是( )
| X | ||
| Z |
| A、X位于第二周期第ⅣA族 |
| B、原子半径由小到大的顺序为:W<Z<Y |
| C、Z、W两元素的气态氢化物中,Z的气态氢化物更稳定 |
| D、无论氧气是否过量,Z在氧气中燃烧的产物唯一 |
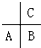 短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )
短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )| A、若均为非金属元素,其气态氢化物稳定性:A<B<C |
| B、若均为金属元素,其最高价氧化物的水化物的碱性:A<B<C |
| C、原子半径:A>C>B |
| D、最高正价:A>B>C |