题目内容
5.工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr O42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol•L-1 时可视作该离子不存在.下列有关说法中,正确的是( )
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
分析 A.步骤①中加酸,氢离子浓度增大,平衡正向移动;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,结合Ksp计算.
解答 解:A.步骤①中加酸,氢离子浓度增大,平衡正向移动,则CrO42-离子浓度减小,故A错误;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等,则该反应不能达到平衡,故B错误;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2•6H2O,故C正确;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,由Ksp可知,c(Cr3+)=$\frac{1{0}^{-32}}{(1{0}^{-10})^{3}}$=10-2mol/L,废水中的铬元素没有除尽,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,涉及反应速率、平衡移动、转移电子计算、溶解度计算等,注重学生知识迁移应用能力的考查,题目难度中等.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
3.下列实验操作中,所用仪器使用合理的是( )
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
4. (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
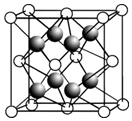
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
④写出Cu原子核外电子排布式[Ar]3d104s1;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
 (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
1.下列各离子能大量共存的是( )
| A. | 无色透明的溶液中:Na+、SO42-、MnO4-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、Cu2+、SO42-、Cl- | |
| C. | pH=1的溶液中:K+、ClO-、S2-、Cl- | |
| D. | 弱碱性的溶液中:Na+、K+、HCO3-、NO3- |
10.(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如表:
则依据表中数据,该NaOH溶液的物质的量浓度为0.1044mol•L-1.
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是C.
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管.(填仪器名称)
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是C.
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管.(填仪器名称)
17.某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液.
(2)滴定
①用碱式滴定管量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.201 0mol•L-1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不恢复时停止滴定.
(3)数据处理
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为0.4020mol•L-1,烧碱的纯度为98.05%(保留两位小数).
(4)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是(多选)ABDH
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大.
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液.
(2)滴定
①用碱式滴定管量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.201 0mol•L-1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不恢复时停止滴定.
(3)数据处理
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
(4)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是(多选)ABDH
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大.
14.用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在A(填编号字母)称量.
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol•L-1的盐酸来滴定待测溶液,不可选用B(填编号字母)作指示剂.
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视眼睛注视锥形瓶中溶液颜色变化;在铁架台上垫一张白纸,其目的是便于观察溶液颜色变化.
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol•L-1,烧碱样品的纯度是97.56%.
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果偏高.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在A(填编号字母)称量.
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol•L-1的盐酸来滴定待测溶液,不可选用B(填编号字母)作指示剂.
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视眼睛注视锥形瓶中溶液颜色变化;在铁架台上垫一张白纸,其目的是便于观察溶液颜色变化.
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol•L-1,烧碱样品的纯度是97.56%.
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果偏高.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
15.S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:①CS2+3Cl2$\stackrel{50-60℃}{→}$CCl4+S2Cl2;②2S+Cl2$\stackrel{95-100}{→}$S2Cl2.已知S2Cl2中硫元素显+1价,电子式: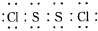 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去).回答下列问题:
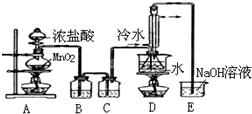
(1)写出A装置中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝回流双重作用.这种冷却装置可应用于下列高中化学中ACD实验.
A.石油分馏 B.制备乙烯
C.制取乙酸乙酯 D.制取溴苯
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,拆除装置时,应先将E中长导管移开液面,目的是防止倒吸.
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O.(用离子方程式表示)
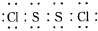 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |

(1)写出A装置中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝回流双重作用.这种冷却装置可应用于下列高中化学中ACD实验.
A.石油分馏 B.制备乙烯
C.制取乙酸乙酯 D.制取溴苯
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,拆除装置时,应先将E中长导管移开液面,目的是防止倒吸.
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O.(用离子方程式表示)
 甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示: