题目内容
10.(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如表:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是C.
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管.(填仪器名称)
分析 (1)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸);
(2)利用c(碱)=$\frac{c酸V酸}{V碱}$来进行浓度计算;
(3)高锰酸钾具有氧化性,所以准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管.
解答 解:(1)由三次盐酸溶液的体积可知,舍去第2组数据,求出1、3组平均消耗V(盐酸)平均值为$\frac{26.11+26.09}{2}$=26.10mL,②由c(碱)=$\frac{c酸V酸}{V碱}$可知,c(碱)=$\frac{0.1000mol/L×26.10mL}{25mL}$=0.1044mol/L,
故答案为:0.1044 mol•L-1;
(2)由c(碱)=$\frac{c酸V酸}{V碱}$可知,
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,消耗酸的体积增大,则c(碱)偏大,故A不选;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,消耗酸的体积增大,则c(碱)偏大,故B不选;
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数,实际上加入的标准液体积偏小,所以碱的浓度偏低,故C选;
D.读取盐酸体积时,仰视读数记录,读数偏小,则差偏大,即消耗酸的体积偏大,所以c(碱)偏高,故D不选;
故答案为:C;
(3)高锰酸钾具有氧化性,所以准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管,故答案为:酸式滴定管.
点评 本题考查中和滴定,明确滴定实验中的仪器、数据处理及中和滴定的误差分析是解答本题的关键,注意酸碱中和的实质,题目难度中等.

练习册系列答案
相关题目
8.在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是( )
| A. | v(A)=0.9 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=1.4 mol/(L•s) | D. | v(D)=1.8 mol/(L•s) |
9.用NA表示阿伏加德罗常数的数值,则下列说法中不正确的是( )
| A. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| B. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数小于NA个 | |
| C. | 2.3g金属钠变为钠离子失去0.1NA电子 | |
| D. | 2.24L CO2中含有的原子数为3×0.1×6.02×1023 |
6.某同学通过一系列实验探究Cu及其化合物的性质,操作正确且能达到目的是( )
| A. | 将铜粉与硫粉混合均匀加热以制取CuS | |
| B. | 将铜丝插入浓硫酸中并加热,反应后再加水以观察CuSO4溶液的颜色 | |
| C. | 向CuSO4溶液中加入过量的NaOH溶液,过滤洗涤并收集沉淀充分灼烧以制取CuO | |
| D. | 向淀粉溶液中加入适量稀硫酸微热,再加少量新制Cu(OH)2并加热,产生砖红色沉淀 |
5.工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr O42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol•L-1 时可视作该离子不存在.下列有关说法中,正确的是( )
CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr O42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol•L-1 时可视作该离子不存在.下列有关说法中,正确的是( )
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
15.已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 | |
| D. | 将AgCl加入到较浓的KI溶液中,AgCl能转化为AgI |
19.用已知浓度的盐酸滴定由NaOH固体配成的溶液时,下列操作会使滴定结果偏低的是( )
| A. | NaOH固体称量时间过长 | B. | 盛放标准盐酸的滴定管用碱液润洗 | ||
| C. | 用酚酞作指示剂 | D. | 固体NaOH中含有Na2O杂质 |
20.氯仿(CHCl3)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化.实验室中可用热还原CCl4法制备氯仿,装置示意图如图1及有关数据如下:
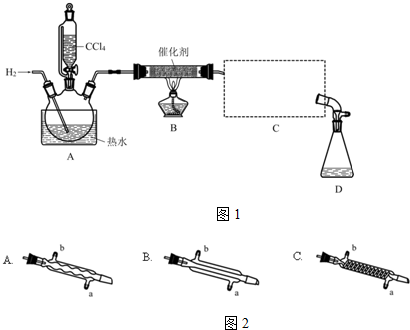
实验步骤:
①检验装置气密性;
②开始通入H2;
③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入20mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为加热时氢气遇氧气发生爆炸;生成的氯仿被氧气氧化.
(2)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
(3)C处中应选用的冷凝管为如图2B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(4)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(5)该实验中,氯仿的产率为61%.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为2CHCl3+O2=2COCl2+2HCl.

| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
①检验装置气密性;
②开始通入H2;
③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入20mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为加热时氢气遇氧气发生爆炸;生成的氯仿被氧气氧化.
(2)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
(3)C处中应选用的冷凝管为如图2B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(4)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(5)该实验中,氯仿的产率为61%.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为2CHCl3+O2=2COCl2+2HCl.