题目内容
15.S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:①CS2+3Cl2$\stackrel{50-60℃}{→}$CCl4+S2Cl2;②2S+Cl2$\stackrel{95-100}{→}$S2Cl2.已知S2Cl2中硫元素显+1价,电子式: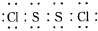 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
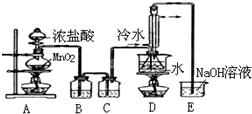
(1)写出A装置中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝回流双重作用.这种冷却装置可应用于下列高中化学中ACD实验.
A.石油分馏 B.制备乙烯
C.制取乙酸乙酯 D.制取溴苯
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,拆除装置时,应先将E中长导管移开液面,目的是防止倒吸.
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O.(用离子方程式表示)
分析 制备S2Cl2原理是:在装置A中二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混油HCl和水,应该先用饱和食盐水除去HCl(装置B),再用浓硫酸干燥氯气(装置C),让氯气和二硫化碳在一定温度下发生反应(装置D):2S+Cl2$\stackrel{95-100℃}{→}$S2Cl2,为了使CS2平稳汽化,避免产物S2Cl2汽化,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可试验中的氯气要进行尾气处理,可以用氢氧化钠来吸收.
(1)二氧化锰和浓盐酸加热反应生成氯气、水和氯化锰;
(2)二氧化锰和稀盐酸不反应;
(3)根据物质的制备实验结合装置的性质来回答;
(4)氯气中的HCl以及水杂质应该除去,根据表中物质的沸点高低可以进行物质的分离;
(5)实验中的处理方案以及实验结束的安全措施要引起注意;
(6)根据题干信息:S2Cl2在水中易发生岐化反应来书写反应方程式,在酸性环境下,氯离子和次氯酸根离子之间可以发生归中反应得到氯气.
解答 解:(1)用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸,因为稀盐酸还原性弱,反应困难,故答案为:稀盐酸还原性弱,反应困难;
(3)D中冷凝管起到导气和冷凝回流双重作用,此作用在制取乙酸乙酯和溴苯、石油分馏的试验中用得到,故答案为:ACD;
(4)制取氯气时,其中的HCl杂质应该用饱和食盐水除去,根据表中物质的沸点高低,为了使CS2平稳汽化,避免产物S2Cl2汽化,可以采用水浴加热的方法,结束后从锥形瓶内混合物中分离出S2Cl2的方法是蒸馏,控制温度在137℃,
故答案为:饱和食盐水;蒸馏;使CS2平稳汽化,避免产物S2Cl2汽化;
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性的检查,再添加试剂.实验完毕,拆除装置时,为防止倒吸,应先将E中长导管移开液面,
故答案为:气密性检查;防止倒吸;
(6)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,无色刺激性气味气体除氯化氢外,依据氧化还原反应的元素化合价变化守恒推断,化合价降低的生成黄色沉淀为单质硫,化合价升高的生成二氧化硫气体,依据原子守恒、电子守恒写出化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,吸收了氯气的氢氧化钠溶液中含有氯化钠、次氯酸钠,向其中加入浓盐酸,则在酸性环境下,氯离子和次氯酸根离子之间可以发生归中反应得到氯气,反应为:ClO-+2H++Cl-=Cl2↑+H2O,
故答案为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;ClO-+2H++Cl-=Cl2↑+H2O.
点评 本题考查物质的制备,为高考常见题型,题目涉及混合物分离的方法判断,杂质气体除杂的装置选择和试剂选择,题干信息的应用分析,离子方程式书写,关键是掌握整个制备流程原理,分析流程中各装置的作用.要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,题目难度中等.

CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr O42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol•L-1 时可视作该离子不存在.下列有关说法中,正确的是( )
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
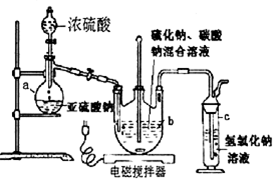
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动.
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2气体.
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜.
④冷却结晶、抽滤、洗涤.
⑤将晶体放入烘箱中,在40~45℃左右干燥50~60min,称量.
请回答以下问题:
(l)仪器a的名称是蒸馏烧瓶;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因:S2O32-+2H+=S↓+H2O+SO2↑.
(3)步骤③中不能将溶液蒸发至干的原因是蒸干会使硫代硫酸钠脱水并分解;晶膜通常在溶液表面出现的原因是因为溶液表面温度较低.
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是
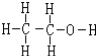 .
.(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol•L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去H半分钟不变色时到达滴定终点.实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定管末用Na2S2O3溶液润洗 B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗 D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡.
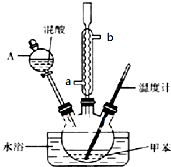 某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):
某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):反应原理:
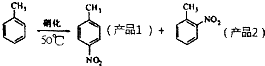
实验步骤:①配制浓硫酸与浓硝酸(按体积比1:3)的混合溶液(即混酸)40mL;
②在三颈瓶中加入15mL(13g)甲苯,
③按图所示装好药品,并装好其他仪器;
④向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器以略去);
⑤控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑥分离出一硝基甲苯.
实验中可能用到的数据:
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 产品1 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 产品2 | 1.162 | 222 | 不溶于水,易溶于液体烃 |
(1)配制40mL混酸的操作是将30mL浓硝酸注入烧杯中,再沿烧杯内壁注入10mL浓硫酸,边加边搅拌;
(2)本实验中浓硫酸的作用是催化剂、吸水剂;
(3)装置中仪器A使用前须清洗干净并检漏;
(4)分离产品的方案如下:

操作2必需的玻璃仪器共有6种.
(5)若最终得到产品1和产品2的总质量为17.42g,则一硝基甲苯的总产率是89.99%(保留两位小数)
(1)如用图I装置制取氨气,锥形瓶中可选择的试剂是氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰)等.
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
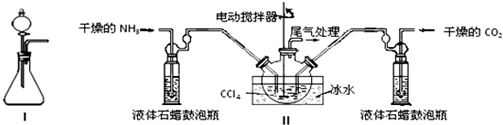
注:CCl4与液体石蜡均为惰性介质.
①%2图I中滴加液体的仪器名称是分液漏斗,液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率),发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称),为了得到干燥产品,应采取的方法是b(填写选项序号).
a.常压加热烘干 b.减压40℃以下烘干 c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
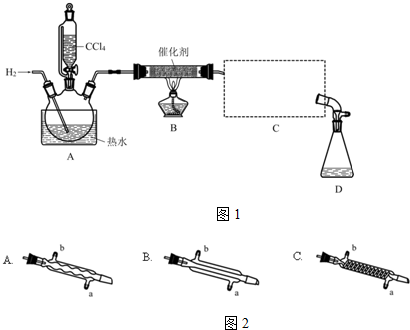
①检验装置气密性;
②开始通入H2;
③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入20mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为加热时氢气遇氧气发生爆炸;生成的氯仿被氧气氧化.
(2)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
(3)C处中应选用的冷凝管为如图2B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(4)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(5)该实验中,氯仿的产率为61%.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为2CHCl3+O2=2COCl2+2HCl.
| H2C2O4 | 无色晶体 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶体 | 微溶于水,pH=7.2,不溶于乙醇 |
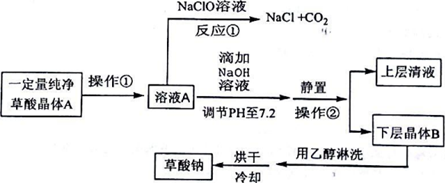
请回答下列问题:
(1)写出反应①的化学方程式H2C2O4+NaC1O=NaC1+2CO2↑+H2O.表明草酸具有还原性.
(2)向溶液A中加入NaOH溶液,开始滴加速度要尽量快些.其目的是利用中和反应放热,升温促进反应(或增大反应速率).该反应达到终点时的化学方程式为H2C2O4+2NaOH=Na2C2O4↓+2H2O.
(3)操作②的名称是过滤.用乙醇淋洗晶体B的目的是除去晶体表面水分减少损失
(4)用0.01000mol/L的高锰酸钾溶液滴定25.00mL某浓度的草酸钠溶液时.需要加入适量的稀硫酸,所发生反应为:5C2O42-+2MnO4-+16H+═2Mn2++10CO2↑+8H2O,若硫酸加入太多,结果会草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,减慢反应速率:操作中需用酸式演定管(填“酸式”或“碱式”),当达到反应终点时的现象是溶液呈现浅紫色且30s内不褪色;测得此时消耗上述高锰酸钾溶液20.00mL,则该草酸钠溶液浓度为0.0200mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应注视锥形瓶内容液颜色变化;
(3)该小组在步骤①中的错误是锥形瓶不能用待测液润洗,由此造成的测定结果偏高(填偏高、偏低或无影响);
(4)步骤②缺少的操作是用标准液润洗滴定管;
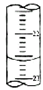
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
(6)根据下列数据:
| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |