题目内容
11.下列相关示意图正确的是( )| A | B | C | D |
| 将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
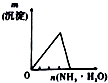
分析 A.氢氧化铝沉淀不能溶于过量的氨水;
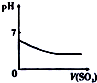
B.二氧化硫与氯气反应生成盐酸和硫酸;
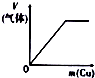
C.将铜粉加入到浓硝酸中至过量,一开始生成NO2,后来生成NO;
D.HF分子间存在氢键沸点最高.
解答 解:A.将氨水滴到氯化铝溶液中至过量,一开始生成氢氧化铝沉淀,当氨水过量时,氢氧化铝沉淀不能溶于过量的氨水,故A错误;
B.氯水具有强氧化性,将二氧化硫逐渐通入氯水中至过量,二氧化硫与氯气反应生成盐酸和硫酸,溶液的酸性增强,pH减小,故B正确;
C.将铜粉加入到浓硝酸中至过量,一开始Cu与浓硝酸反应生成NO2,当硝酸变为稀硝酸时,Cu与稀硝酸反应生成NO,产生气体的速率不同,所以图象不符合,故C错误;
D.HF分子间存在氢键沸点最高,则卤族元素的氢化物沸点随核电荷数的变化:HF>HBr>HCl,故D错误.
故选B.
点评 本题考查了元素化合物的性质,题目难度不大,题目涉及铝的化合物、氯水、二氧化硫、硝酸等物质,侧重于基础知识的考查.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
1. 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出元素O的基态原子电子排布式1s22s22p63s23p63d64s2.
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表Si(填元素符号);其中电负性最大的是2(填图中的序号).
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是SiC(填化学式),试从结构角度加以解释:因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高.
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
(1)请写出元素O的基态原子电子排布式1s22s22p63s23p63d64s2.
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表Si(填元素符号);其中电负性最大的是2(填图中的序号).
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是SiC(填化学式),试从结构角度加以解释:因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高.
2.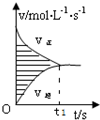 在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )
在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )
 在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )
在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )| A. | 反应起始时,X、Y、Z 三种物质同时存在 | |
| B. | t1 时刻,X、Y、Z 浓度不再发生变化,反应停止 | |
| C. | 若该反应在更大的压强下进行,达平衡时,阴影部分面积不变 | |
| D. | 若该反应在加入催化剂的条件下进行,达平衡时,阴影部分面积不变 |
19.下列有关实验设计或操作、观察或记录、结论或解释都正确的是( )
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| B | 向10mL 0.2mol/L AgNO3溶液中滴入2滴0.1mol/L NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol/LKI溶液 | 白色沉淀转化为黄色沉淀 | 证明在相同温度下的Ksp:AgCl>AgI |
| C | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| D | 把SO2通入橙色的溴水中 | 橙色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
16.元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,下列推测不正确的是( )
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同主族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价氧化物对应水化物的酸性最强 |
3.将12.3g铜铝合金溶于稀硝酸中,恰好完全反应生成标准状况下4.48L NO气体,在反应后的溶液中加入氢氧化钠溶液,当完全反应时消耗氢氧化钠溶液的体积最多为200mL,则氢氧化钠溶液的浓度为( )
| A. | 2.5mol•L-1 | B. | 3mol•L-1 | C. | 3.5mol•L-1 | D. | 4mol•L-1 |
12.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图:
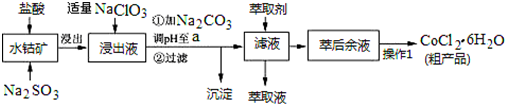
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)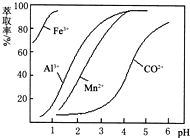

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
