题目内容
13.已知33As、35Br位于同一周期.某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X.(1)已知KBrO3在反应中得到电子,则该反应的还原剂是AsH3.
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式是Br2.
(3)在该反应条件下可推知ac(填序号).
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为8:5,其中1mol KBrO3得到电子的物质的量为5mol.
分析 由信息可知,该反应中氧化剂是KBrO3,还原剂是AsH3,溴元素化合价变化为由+5价降低,As元素化合价变化为-3→+5价,
(1)化合价升高元素所在的反应物是还原剂;
(2)根据溴元素化合价的降低情况来计算;
(3)根据氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此判断;
(4)根据氧化剂化合价降低得电子,还原剂化合价升高失电子结合得失电子守恒进行计算.
解答 解:(1)KBrO3在反应中得到电子,所以KBrO3化合价降低是氧化剂,AsH3变成了H3AsO4,所以AsH3是还原剂,故答案为:AsH3;
(2)设X中溴元素的化合价为x,则0.2mol(5-x)=1mol,所以x=0,故X为Br2,故答案为:Br2;
(3)a、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故a正确,b错误;
c、AsH3是还原剂,X是还原产物,所以还原性AsH3>X,故c正确,故d错误.
故选:ac;
(4)还原剂AsH3中化合价升高的元素是砷元素,化合价从-3价升到+5价升高8,氧化剂KBrO3中化合价降低的元素是溴元素,化合价从+5价降到0价降低5,根据得失电子守恒,所以氧化剂和还原剂的物质的量之比为8:5;KBrO3与HBr反应也会生成X,则还原剂HBr中化合价升高的元素是Br元素,化合价从-1价升到0价升高1,氧化剂KBrO3中化合价降低的元素是溴元素,化合价从+5价降到0价降低5,其中1mol KBrO3得到电子的物质的量为5mol,
故答案为:8:5;5.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列相关示意图正确的是( )
| A | B | C | D |
| 将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
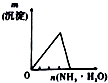 | 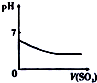 | 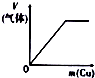 |  |
| A. | A | B. | B | C. | C | D. | D |
4.下列说法不正确的是( )
| A. | 生物质能来源于植物及其加工产品所存贮的能量,绿色植物通过光合作用将化学能转化成生物质能 | |
| B. | 2015年8月国内油价再次迎来成品油最高零售价的下调,上演了年内首场“四连跌”,但油品从国Ⅳ汽油升级到Ⅴ汽油,有助于减少酸雨、雾霾,提高空气质量 | |
| C. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温下可用金属钠还原四氯化钛来制取金属钛 | |
| D. | 元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属 |
1.下列说法正确的是( )
| A. | 1mol酸与1mol碱完全反应放出的热量就是中和热 | |
| B. | 如果反应在加热时才能发生,则该反应是吸热反应 | |
| C. | 反应物总能量大于生成物总能量,则反应的△H<0 | |
| D. | 强酸强碱中和热的离子方程式可表示为:H+(aq)+OH-(aq)═H2O(l)△H=57.3 kJ/mol |
8.已知反应A+B═C+D的能量变化如图所示,下列说法正确的是( )


| A. | 该反应只有在加热条件下才能进行 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 反应物的总能量高于生成物的总能量 |
18.化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料的燃烧 | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能源 |
2.二氧化碳制取碳的太阳能工艺原理如图所示,下列有关说法中正确的是( )
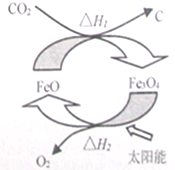

| A. | 由二氧化碳制取碳和氧气的反应为放热反应 | |
| B. | 该循环反应中,FeO的质量减小 | |
| C. | 根据盖斯定律可知,△H1+△H2=0 | |
| D. | 该反应是将太阳能转化为化学能 |
3.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,乙醇和水,己烯和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 己烷和水,乙醛和水,乙酸和乙醇 | |
| D. | 乙酸和水,甲苯和水,己烷和己烯 |
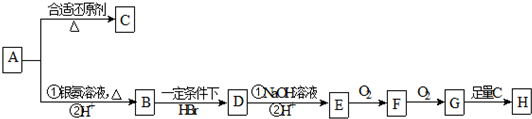
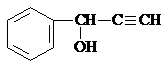 、
、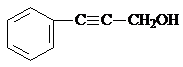 .
.