题目内容
6.300mL 2mol/L H2SO4 溶液与足量的锌反应,求①生成的气体在标准状况下的体积是多少?②如果反应后溶液体积不变,生成的ZnSO4的物质的量浓度为多少?分析 n( H2SO4)=0.3L×2mol/L=0.6mol,发生Zn+H2SO4=ZnSO4+H2↑,结合反应、V=nVm、c=$\frac{n}{V}$计算.
解答 解:n( H2SO4)=0.3L×2mol/L=0.6mol,Zn足量,则硫酸完全反应,
①由Zn+H2SO4=ZnSO4+H2↑可知,生成的气体在标准状况下的体积是0.6mol×22.4L/mol=13.44L,
答:生成的气体在标准状况下的体积是13.44L;
②如果反应后溶液体积不变,生成的ZnSO4的物质的量为0.6mol,其浓度为$\frac{0.6mol}{0.3L}$=2mol/L,
答:ZnSO4的物质的量浓度为2mol/L.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意硫酸完全反应,题目难度不大.

练习册系列答案
相关题目
16.下列因果关系成立的是( )
| A. | 因为SiO2能与强碱溶液反应,所以盛装强碱溶液的试剂瓶不用玻璃塞 | |
| B. | 因为SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH | |
| D. | 因为NH3的水溶液可以导电,所以NH3是电解质 |
17.下列有关说法正确的是( )
| A. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 | |
| B. | 常温常压下,足量的Fe在1 mol Cl2中充分燃烧,转移的电子数为2NA(NA为阿伏加德罗常数的值) | |
| C. | 卤族元素单质X2(X:代表F、Cl、Br、I)均可以与水反应生成HXO | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 |
14.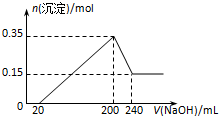 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )
 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )| A. | 镁和铝的总质量为9 g | |
| B. | 最初20 mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为5 mol•L-1 | |
| D. | 生成的氢气在标准状况下的体积为11.2 L |
1.已知a、b、c、d、e是短周期中原子序数依次增大的5种主族元素,其中元素a、e的单质在常温下呈气态,元素b的原子最外层电子数是其电子层数的2倍,元素c在同周期的主族元素中原子半径最大,元素d的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 原子半径:b<c<d | |
| B. | 金属性:d>c | |
| C. | 化合物ae与ce含有的化学键类型相同 | |
| D. | c、d的最高价氧化物对应的水化物之间能发生反应 |
11.下列相关示意图正确的是( )
| A | B | C | D |
| 将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
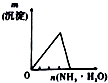 |  | 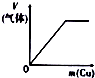 |  |
| A. | A | B. | B | C. | C | D. | D |
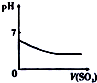
8.已知反应A+B═C+D的能量变化如图所示,下列说法正确的是( )


| A. | 该反应只有在加热条件下才能进行 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 反应物的总能量高于生成物的总能量 |