题目内容
17.已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为H2RO4═H++HRO4-;HRO4-?H++RO42-回答下列问题:(1)NaHRO4溶液显酸性(填“酸性”,“中性”,或“碱性”).理由是:HRO4-只电离不水解
(2)在0.1mol•L-1的Na2RO4溶液中,下列微粒浓度关系式正确的是:BCD.
A.c(RO42-)+c(HRO4-)+c(H2RO4)=0.1mol•L-1
B.c(OH-)=c(H+)+c(HRO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HRO4--)+2c(RO42-)
D.c(Na+)=2c(RO42-)+2c(HRO4-)
(3)如果25℃时,0.1mol•L-1NaHRO4溶液的中,c(RO42-)=0.029mol•L-1 则0.1mol•L-1 H2RO4中c(RO42-)<0.029mol•L-1(填“<”,“>”,或“=”).
(4)如果25℃时,0.1mol•L-1H2RO4溶液的中,pH=-lg0.11,则此时溶液中c(RO42-)=0.01mol•L-1.
分析 (1)Na2RO4为强碱弱酸盐,酸根离子水解导致溶液呈碱性;
(2)电解质溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
(3)H2RO4电离产生的H+抑制 HRO4-电离;
(4)H2RO4的第一步电离是完全电离,第二步电离是不完全电离,溶液中c(RO42-)等于第二步电离的氢离子浓度.
解答 解:(1)由电离可知,NaHRO4溶液电离出氢离子:HRO4-?H++RO42-,且HRO4-不水解,则溶液显酸性,
故答案为:酸性;HRO4-只电离不水解;
(2)A.HRO4-只发生电离不发生水解,所以溶液中不存在H2RO4,故A错误;
B.根据质子守恒得:c(OH-)=c(H+)+(HRO4-),故B正确;
C.根据电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(HRO4-)+2c(RO42-),故C正确;
D.根据物料守恒得:c(Na+)=2c(RO42-)+2c(HRO4-),故D正确;
故答案为:BCD;
(3)H2RO4═H++HRO4-电离产生的H+抑制 HRO4-?H++RO42-的电离,所以0.1mol/LH2RO4溶液中c(RO42-)<0.029mol/L,
故答案为:<;
(4)的第一步电离是完全电离,第二步电离是不完全电离,溶液中c(RO42-)等于第二步电离的氢离子浓度,0.10mol•L-1 H2RO4溶液中第一步电离得到的氢离子浓度为0.1mol/L,因为溶液的pH=-lg0.11,所以第二步电离的氢离子浓度为0.01mol/L,溶液中c(RO42-)等于第二步电离的氢离子浓度,则0.10mol•L-1的H2RO4溶液中c(RO42-)=0.01mol/L,
故答案为:0.01.
点评 本题考查离子浓度大小的比较,题目难度中等,明确酸的两步电离及电离、水解的判断为解答的关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

| A. | 除去CuSO4溶液中的Fe(SO4)3,加入足量CuO粉末,充分搅拌过滤 | |
| B. | 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多 | |
| C. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| D. | 铁管道与直流电源正极相连,可缓解管道腐蚀 |
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| D. | H2O2具有还原性,可用于与酸性高锰酸钾溶液反应制取少量氧气 |
①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p5.则下列有关比较中正确的是( )
| A. | 第一电离能:③>②>① | B. | 原子半径:①>②>③ | ||
| C. | 电负性:③>②>① | D. | 最高正化合价:③>①>② |
 可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )| A. | 若a=1,则A为液体或固体 | |
| B. | 该反应正反应为放热反应 | |
| C. | T2>T1,p2>p1 | |
| D. | 其他条件不变,增加B的物质的量,化学平衡向正反应方向移动,化学平衡常数K增大 |
| A. | Na2FeO4在净水过程中能转变成氢氧化铁 | |
| B. | Na2FeO4能杀菌消毒 | |
| C. | Na2FeO4能除去水中的硫化氢等还原性气体杂质 | |
| D. | Na2FeO4能吸附水中的颜色和固体颗粒 |
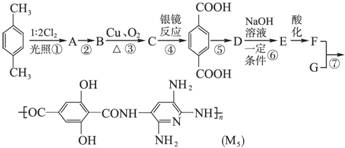
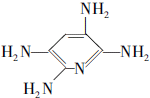 ,F的含氧官能团的名称有酯基和酚羟基.
,F的含氧官能团的名称有酯基和酚羟基.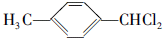 .
.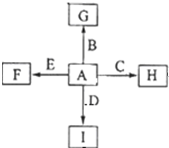 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知: