��Ŀ����
6��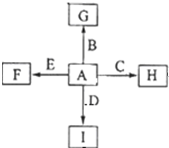 ��ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�������֪��
��ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�������֪���ٷ�ӦC+G$\stackrel{����}{��}$B+H�ܷų��������ȣ�G�Ǻ���ɫ�����ĩ��
��I��һ�ֳ������������壬����E���Է�����Ӧ��2E+I$\frac{\underline{\;��ȼ\;}}{\;}$2F+D��F�е�EԪ�ص���������Ϊ60%��
�ش����⣺
��1�����з�Ӧ�Ļ�ѧ����ʽΪ2Al+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3��
��2��1.6g G �������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ��������Ҫͭ��6.4�ˣ�
��3��C�����NaOH��Һ��Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2����
��Ӧ�����Һ������Ļ�����I��Ӧ�����ӷ���ʽΪAlO2-+CO2+2H2O=Al��OH��3��+HCO3-��
��4��E��I��Ӧ�Ļ�ѧ����ʽΪ2Mg+CO2$\frac{\underline{\;��ȼ\;}}{\;}$2MgO+C��
��5��д��H�����ڹ�ҵ�ϵ�һ����;�ͻ���ϻ�������
��6����һ������B��ȫ���ڹ��������У�Ȼ��ͨ��0.005molCl2���ټ���0.01mol�ظ���ؾ��壨K2Cr2O7����ǡ��ʹ��Һ��B2+ȫ��ת��ΪB3+����Ԫ�ر�������ԭΪ+3�۸����ӣ�ͨ������ȷ��ԭB�����ʵ���ΪD��
A��0.01mol B��0.03mol C��0.04mol D��0.07mol��
���� ��G�Ǻ���ɫ�����ĩ�����G��Fe2O3��C+Fe2O3��Fe+H���˷�Ӧ�����û���Ӧ���������⣨3��C�ܺ�NaOH��Ӧ������Ƴ�C��Al��HΪAl2O3������Ƴ�A��O��B��Fe�����dz������������壬Iһ����CO2������2E+CO2=2F+D��D��C������ԭ���غ���F��ѧʽΪEO��F�е�EԪ����������Ϊ60%����O����������Ϊ40%����$\frac{16}{M+16}$��100%=40%�����M=24����E��Mg��F��MgO��
��1�����������ƶϣ���Ӧ�����������������������ȷ�Ӧ����������������
��2��Fe2O3+6H+=2Fe3++3H2O��Cu+2Fe3+=2Fe2++Cu2+����˽�����ϵ��Fe2O3��2Fe3+��Cu���ݴ˼��㣻
��3�����������������Ʒ�Ӧ����ƫ�����ƺ�������̼�������ǿ��ƫ��������ԣ�����������̼ͨ��ƫ��������Һ������̼�����ƺ���������������
��4��E��I��Ӧ�ǽ���þ��CO2��ȼ������̼������þ��
��5��Al2O3�۷е�ߣ����������²��ϣ���ҵ�ϳ��������״̬���������õ����������������������������ԭ�ϣ�
��6����һ������Fe��ȫ���ڹ��������У�Ȼ��ͨ��0.005mol Cl2���ټ���0.01mol�ظ���ؾ��壨K2Cr2O7����ǡ��ʹ��Һ��Fe2+ȫ��ת��ΪFe3+����Ԫ�ر�������ԭΪ+3�۸����ӣ�����������ԭ��Ӧ��ʧ�����������ʽ���㣮
��� �⣺��G�Ǻ���ɫ�����ĩ�����G��Fe2O3��C+Fe2O3��Fe+H���˷�Ӧ�����û���Ӧ���������⣨3��C�ܺ�NaOH��Ӧ������Ƴ�C��Al��HΪAl2O3������Ƴ�A��O��B��Fe�����dz������������壬Iһ����CO2������2E+CO2=2F+D��D��C������ԭ���غ���F��ѧʽΪEO��F�е�EԪ����������Ϊ60%����O����������Ϊ40%����$\frac{16}{M+16}$��100%=40%�����M=24����E��Mg��F��MgO��
��1�����������ƶϣ���Ӧ�ٻ�ѧ��Ӧ����ʽΪ2Al+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3��
�ʴ�Ϊ��2Al+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3��
��2��1.6g GΪFe2O3�����ʵ���=$\frac{1.6g}{160g/mol}$=0.01mol �������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ��Fe2O3+6H+=2Fe3++3H2O��Cu+2Fe3+=2Fe2++Cu2+��
��˽�����ϵ��Fe2O3��2Fe3+��Cu��
����m��Cu��=0.01mol��64g/mol=0.64g��
�ʴ�Ϊ��0.64��
��3��C�����NaOH��Һ��Ӧ�ǽ��������������Ʒ�Ӧ�����ӷ�Ӧ����ʽΪ��2Al+2OH-+2H2O=2AlO2-+3H2������Ӧ�����Һƫ��������Һ������Ļ�����IΪ������̼��Ӧ��̼�������ǿ��ƫ��������ԣ������AlO2-+CO2+2H2O=Al��OH��3��+HCO3-��
�ʴ�Ϊ��2Al+2OH-+2H2O=2AlO2-+3H2����AlO2-+CO2+2H2O=Al��OH��3��+HCO3-��
��4��E��I��Ӧ�ǽ���þ��CO2��ȼ�գ��䷴Ӧ����ʽΪ2Mg+CO2$\frac{\underline{\;��ȼ\;}}{\;}$2MgO+C��
�ʴ�Ϊ��2Mg+CO2$\frac{\underline{\;��ȼ\;}}{\;}$2MgO+C��
��5��Al2O3�۷е�ߣ����������²��ϣ���ҵ�ϳ��������״̬���������õ����������������������������ԭ�ϣ�
�ʴ�Ϊ���ͻ���ϡ�������
��6����һ������Fe��ȫ���ڹ��������У�Ȼ��ͨ��0.005mol Cl2���ټ���0.01mol�ظ���ؾ��壨K2Cr2O7����ǡ��ʹ��Һ��Fe2+ȫ��ת��ΪFe3+����Ԫ�ر�������ԭΪ+3�۸����ӣ�Fe+2HCl=Fe2++H2����2Fe+Cl2=2Cl-+2Fe3+������������ԭ��Ӧ��ʧ��������ȣ�n��Fe2+����1=n��Cl2����2+n��K2Cr2O7����2��3����n��Fe2+��=0.005mol��2+0.01mol��2��3=0.07mol��
�ʴ�Ϊ��D��
���� ���⿼��������ƶϣ�ע���������ȷ�Ӧ������ЧӦ���塢Mg�������̼�ķ�ӦΪ������ͻ�ƿڣ���ϤMg��Al���仯��������ʼ�������ԭ��Ӧ���ɽ����Ŀ�Ѷ��еȣ�

| X | ||
| Z |
��1��Ԫ��X�����ڱ���λ��IVA�壻W��Z����̬�⻯���ȶ��ԱȽϣ����ǿ����HCl���ѧʽ����
��2��W�ĵ�����ˮ��Ӧ���ɵĺ�����ĵ���ʽΪ
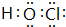
��3����BaCl2��Һ�м�������Y������������Ӧˮ������Һ����ͨ��ZO2���壬��������ɫ����YO�Ͱ�ɫ����BaSO4���ѧʽ����ZO2��YO��ԭ�ԱȽϣ����ǿ����SO2���ѧʽ����
| A�� | ʯ��ˮ��̼���� | B�� | ƫ�����ƺ����� | ||
| C�� | ʯ��ˮ������ | D�� | ���������������� |
| A�� | 1mol/LNaCl��Һ | B�� | 2mol/LNH4Cl��Һ | ||
| C�� | 1.5mol/LMgCl2��Һ | D�� | 2mol/LAlCl3��Һ |
| A�� | ����ɫ����ˮ���պ���ɫ��dz | |
| B�� | ������������Һ�У����������Է�ֹ�������� | |
| C�� | ��������Ĺ�����ʹ�ù�����������߰����������� | |
| D�� | ʵ���ҳ����ű���ʳ��ˮ�ķ����ռ����� |
| A�� | �����ụΪͬ���칹�� | B�� | ���ڸ߷��ӻ����� | ||
| C�� | ���ܷ���������Ӧ | D�� | ������ȼ�� |