题目内容
7.高铁酸钠(Na2FeO4)的氧化性强于高锰酸钾和臭氧,是一种高效多功能净水混凝剂.下面关于高铁酸钠净水作用的叙述不正确的是( )| A. | Na2FeO4在净水过程中能转变成氢氧化铁 | |
| B. | Na2FeO4能杀菌消毒 | |
| C. | Na2FeO4能除去水中的硫化氢等还原性气体杂质 | |
| D. | Na2FeO4能吸附水中的颜色和固体颗粒 |
分析 A、Na2FeO4在净水过程中Fe元素的化合价降低为+3价;
B、Na2FeO4具有强氧化性;
C、Na2FeO4具有强氧化性,能与还原性物质反应;
D、Na2FeO4没有吸附性.
解答 解:A、Na2FeO4在净水过程中Fe元素的化合价降低为+3价,即Na2FeO4在净水过程中能转变成氢氧化铁,故A正确;
B、Na2FeO4具有强氧化性,能使细菌和病毒的蛋白质发生变性,因此Na2FeO4能杀菌消毒,故B正确;
C、Na2FeO4具有强氧化性,能与还原性物质反应,所以Na2FeO4能除去水中的硫化氢等还原性气体杂质,故C正确;
D、Na2FeO4没有吸附性,Na2FeO4在净水过程中能转变成氢氧化铁,氢氧化铁能吸附水中的颜色和固体颗粒,故D错误.
故选D.
点评 本题考查了氧化还原反应、铁的化合物的性质,题目难度不大,注意把握氧化还原反应的基本原理,侧重于基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列事实不能用勒夏特列原理解释的是( )
| A. | 黄绿色的氯水光照后颜色变浅 | |
| B. | 在硫酸亚铁溶液中,加入铁粉以防止氧化变质 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 实验室常用排饱和食盐水的方法收集氯气 |
12.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,2.24LCH2Cl2含有分子的数目为0.1NA | |
| B. | 电解精炼铜时,阳极质量减少12.8g时,转移电子0.4NA | |
| C. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| D. | 常温常压下,将0.1mol Fe投入足量的稀硝酸中,转移的电子为0.3 NA |
19.室温下,下列说法中不正确的是( )
| A. | pH=12的NaOH溶液加水稀释100倍,溶液pH=10 | |
| B. | pH=5的盐酸溶液稀释1000倍,溶液的pH约等于7 | |
| C. | pH=2的 H2SO4与pH=12的NaOH溶液等体积混和,溶液pH=7 | |
| D. | pH=12的NH3•H2O与pH=2的HCl溶液等体积混和,混和液pH<7 |
16.下列关于乙醇的说法正确的是( )
| A. | 与乙酸互为同分异构体 | B. | 属于高分子化合物 | ||
| C. | 不能发生氧化反应 | D. | 可用作燃料 |
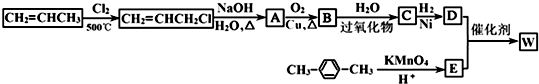
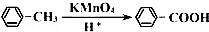
 .
.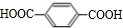 →
→ +2H2O.
+2H2O.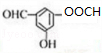 .
.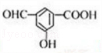 .
.