题目内容
4.下列实验现象不能说明相关结论的是( )| A. | 将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 | |
| B. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 | |
| C. | 向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动 | |
| D. | 向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 |
分析 A.钠熔为小球,说明钠的熔点较低,且反应为放热反应;
B.铜和浓硫酸发生氧化还原反应;
C.根据难溶电解质的溶解平衡解答;
D.氢氧化铝为两性氢氧化物,可与酸、碱反应生成盐和水.
解答 解:A.钠熔为小球,说明钠的熔点较低,且反应为放热反应,故A正确;
B.将铜与浓硫酸共热,产生使石蕊溶液变红的气体,生成的气体为二氧化硫,该反应中浓硫酸起到强氧化性的作用,故B错误;
C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明生成硫化银沉淀,平衡向溶度积更小的方向移动,故C正确;
D.氢氧化铝为两性氢氧化物,可与酸、碱反应生成盐和水,故D正确.
故选B.
点评 本题考查较为综合,多角度考查元素化合物知识,贴近高考,难度中等,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
14.下列有关离子方程错误的是( )
| A. | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | |
| B. | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | 向Ca(OH)2溶液中通入过量 SO2SO2+OH-═HSO3- | |
| D. | 往水玻璃中加入盐酸 SiO32-+2H+═H2SiO3↓ |
12.首次成功解释了氢原子光谱的科学家是( )
| A. | 道尔顿 | B. | 卢瑟福 | C. | 玻尔 | D. | 爱因斯坦 |
9.弱酸HCN溶液中存在着下列平衡:HCN?H++CN-,若要使平衡逆向移动,同时使c(H+)增大,应加入适量的下列物质是( )
| A. | 硫酸 | B. | NaOH固体 | C. | NaCN固体 | D. | 水 |
16. 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).实验记录如下:
| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色. |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
13.第101号元素钔最稳定的一种原子可以表示为${\;}_{101}^{258}Md$,该原子所含中子的数目为( )
| A. | 56 | B. | 157 | C. | 258 | D. | 101 |
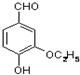 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.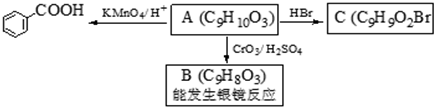
 .
. .
.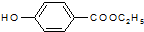 )是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).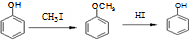
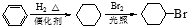
 .
.