题目内容
16. 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).实验记录如下:
| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色. |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
分析 (1)依据装置图分析A中是氯水滴入溴化钠溶液中发生 的氧化还原反应,氯气氧化溴离子为溴单质;A中溶液变为红棕色;
(2)吹入热空气,依据现象分析,A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化.说明为了把A中溴单质全部赶到B装置中吸收反应;
(3)滴入过氧化氢是氧化剂,在酸性溶液中可以把溴离子氧化为溴单质;
(4)依据氧化还原反应中氧化剂的氧化性大于氧化产物分析判断.
解答 解:(1)A中是氯水滴入溴化钠溶液中发生 的氧化还原反应,氯气氧化溴离子为溴单质,A中溶液变为红棕色.反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,
故答案为:2Br-+Cl2=Br2+2Cl-;
(2)吹入热空气,A中红棕色明显变浅,说明溴单质被赶入B在;B中有气泡,产生大量白色沉淀,说明溴单质氧化亚硫酸诶硫酸和氯化钡生成白色沉淀,混合液颜色无明显变化,进一步证明了溴单质被还原为溴离子,
故答案为:吹出单质Br2;
(3)滴入过氧化氢在酸溶液中会氧化溴离子为溴单质,反应的两种方程式根据电子守恒、原子守恒配平书写为:H2O2+2Br-+2H+=Br2+2H2O,
故答案为:H2O2+2Br-+2H+=Br2+2H2O;
(4)依据反应H2SO3+Br2+H2O=H2SO4+2HBr;H2O2+2Br-+2H+=Br2+2H2O;氧化还原反应中 氧化剂的氧化性大于氧化产物,氧化性为:H2O2>Br2>H2SO3,
故答案为:氧化性为H2O2>Br2>H2SO3.
点评 本题考查了物质性质的实验验证方法和实验现象分析,氧化还原反应的强弱规律应用,离子方程式的书写方法,实验方案的设计与分析,题目难度较大.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 在常温常压下,11.2LN2所含有的分子数为0.5NA | |
| B. | 在标准状况下,22.4 L CO和N2的混合物的物质的量为1mol | |
| C. | 在标准状况下,18g H2O的体积为22.4 L | |
| D. | 1mol SO2中原子数为NA个 |
4.下列实验现象不能说明相关结论的是( )
| A. | 将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 | |
| B. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 | |
| C. | 向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动 | |
| D. | 向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 |
11.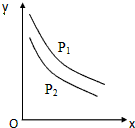 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 增加L平衡右移 | ||
| C. | a>b | D. | a<b |
1.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后pH大于7,下表中判断合理的是( )
| 标号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 弱酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
8.下列各组气态氢化物稳定性由强到弱的顺序排列的是( )
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | H2Se、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |
 2012年夏,发生在多地的暴雨共造成亿万人受灾.水是组成生命体的重要化学物质,也是一种重要的溶剂,同时也是参与化学反应的重要试剂.怎样利用水为百姓造福将是今后研究的重要课题.请回答下列问题:
2012年夏,发生在多地的暴雨共造成亿万人受灾.水是组成生命体的重要化学物质,也是一种重要的溶剂,同时也是参与化学反应的重要试剂.怎样利用水为百姓造福将是今后研究的重要课题.请回答下列问题: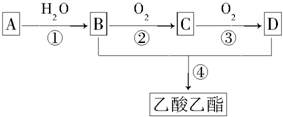
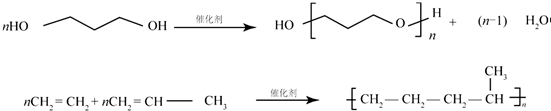
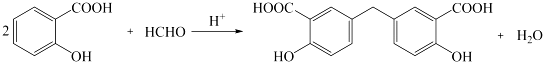
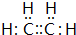 ;C的分子式是C2H4O.
;C的分子式是C2H4O.
 .
.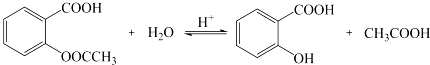 .
.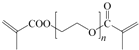 .
. .
. .
.