题目内容
13.第101号元素钔最稳定的一种原子可以表示为${\;}_{101}^{258}Md$,该原子所含中子的数目为( )| A. | 56 | B. | 157 | C. | 258 | D. | 101 |
分析 质量数=质子数+中子数.
解答 解:质量数=质子数+中子数,中子数=质量数-质子数=258-101=157,故选B.
点评 本题考查原子组成,难度不大,注意质量数=质子数+中子数.

练习册系列答案
相关题目
4.下列实验现象不能说明相关结论的是( )
| A. | 将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 | |
| B. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 | |
| C. | 向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动 | |
| D. | 向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 |
1.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后pH大于7,下表中判断合理的是( )
| 标号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 弱酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
8.下列各组气态氢化物稳定性由强到弱的顺序排列的是( )
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | H2Se、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |
18.下列化合物中,不能由单质直接化合得到的是( )
| A. | NO | B. | Na2O2 | C. | FeCl2 | D. | CuCl2 |
2.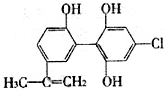 在2010年温哥华冬奥会上,有个别运动员因服用兴奋剂被取消参赛资格.如图是某兴奋剂X的结构简式,下列有关说法正确的是( )
在2010年温哥华冬奥会上,有个别运动员因服用兴奋剂被取消参赛资格.如图是某兴奋剂X的结构简式,下列有关说法正确的是( )
 在2010年温哥华冬奥会上,有个别运动员因服用兴奋剂被取消参赛资格.如图是某兴奋剂X的结构简式,下列有关说法正确的是( )
在2010年温哥华冬奥会上,有个别运动员因服用兴奋剂被取消参赛资格.如图是某兴奋剂X的结构简式,下列有关说法正确的是( )| A. | 1molX在一定条件下与足量的氢气反应,最多消耗1molH2 | |
| B. | 1molX与足量的Na反应,最多产生标况下33.6LH2 | |
| C. | 1molX与足量的浓溴水反应,最多消耗5molBr2 | |
| D. | 1molX与足量的NaOH溶液在一定条件下反应,最多消耗5molNaOH |
19.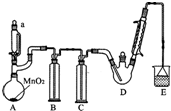 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
(1)仪器a中盛放的试剂是浓盐酸;装置B的作用是除去氯气中的氯化氢.
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右
(3)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行,为什么:CCl3COOH溶于乙醇与CCl3CHO.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)请设计实验证明证明三氯乙酸的酸性比乙酸强.
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙 |
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右
(3)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行,为什么:CCl3COOH溶于乙醇与CCl3CHO.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)请设计实验证明证明三氯乙酸的酸性比乙酸强.
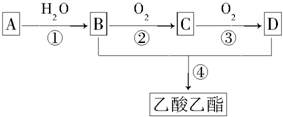
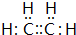 ;C的分子式是C2H4O.
;C的分子式是C2H4O.