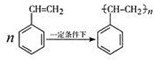
题目内容
14.下列有关离子方程错误的是( )| A. | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | |
| B. | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | 向Ca(OH)2溶液中通入过量 SO2SO2+OH-═HSO3- | |
| D. | 往水玻璃中加入盐酸 SiO32-+2H+═H2SiO3↓ |
分析 A.二者发生置换反应生成硫酸亚铁和铜;
B.不符合反应客观事实;
C.二氧化硫过量反应生成亚硫酸钙;
D.硅酸钠与盐酸反应生成氯化钠和硅酸沉淀.
解答 解:A.将Fe加入CuSO4溶液中,离子方程式; Fe+Cu2+═Cu+Fe2+,故A正确;
B.向氯化铝溶液中加入足量氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.向Ca(OH)2溶液中通入过量,离子方程式:SO2+OH-═HSO3-,故C正确;
D.往水玻璃中加入盐酸,离子方程式:SiO32-+2H+═H2SiO3↓,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实,注意化学式的拆分,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
4.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 元素的电负性 D>C>A>B |
5.下列事实与胶体性质无关的是( )
| A. | 夏日的傍晚常常看到万丈霞光穿云而过,美不胜收 | |
| B. | 食品加工厂利用豆浆中加入盐卤做豆腐 | |
| C. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 某化工厂利用静电除尘技术去除废气中的固体悬浮物 |
9.10mL某气态混合烃在80mL O2中充分燃烧,得到体积为65mL的混合气体(气体体积均在相同条件200C时测定),则该混合物不可能是( )
| A. | 丙烷和丙烯 | B. | 乙烷和丙烯 | C. | 丙烯和丁炔 | D. | 丁烯和丙炔 |
19.Na和Na+两种粒子中,不相同的是( )
①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③④ |
6.下列说法正确的是( )
| A. | 在常温常压下,11.2LN2所含有的分子数为0.5NA | |
| B. | 在标准状况下,22.4 L CO和N2的混合物的物质的量为1mol | |
| C. | 在标准状况下,18g H2O的体积为22.4 L | |
| D. | 1mol SO2中原子数为NA个 |
4.下列实验现象不能说明相关结论的是( )
| A. | 将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 | |
| B. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 | |
| C. | 向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动 | |
| D. | 向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 |
 制取 聚苯乙烯
制取 聚苯乙烯