题目内容
2.下列实验操作与预期实验目的或所得实验结论一致的是( )| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇不发生电离,不属于电解质;
B.二氧化硫不能使指示剂褪色,应该用品红溶液检验二氧化硫的漂白性;
C.氢氧化钠过量,镁离子直接与氢氧根离子生成氢氧化镁沉淀,无法据此判断氢氧化镁和氢氧化铁的溶度积;
D.NaClO具有漂白性,酸性条件下漂白性更强,则滴有醋酸的品红溶液的红色褪色的快.
解答 解:A.钠与乙醇中的羟基H反应生成氢气,但CH3CH2OH不发生分离,为非电解质,故A错误;
B.将SO2气体通入紫色石蕊溶液中,反应生成的亚硫酸使石蕊试液变红,但不会褪色,无法据此检验二氧化硫的漂白性,故B错误;
C.向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,由于氢氧化钠过量,过量的NaOH与加入的氯化镁溶液反应生成氢氧化镁沉淀,无法证明Ksp[Mg(OH)2]、Ksp[Fe(OH)3]的大小,故C错误;
D.向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴NaClO的84消毒液,观察到滴有醋酸的品红溶液的红色褪色的快,说明溶液pH的减少,酸性增强,84消毒液的氧化能力增强,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及电解质与非电解质、二氧化硫、次氯酸的漂白性、难溶物溶度积大小比较等知识,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12.用下列方法均可制得氧气:
①2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl=3O2↑
②2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
④2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$O2↑+2H2O
若要制得相同质量的氧气,反应中电子转移数目之比为( )
①2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl=3O2↑
②2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
④2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$O2↑+2H2O
若要制得相同质量的氧气,反应中电子转移数目之比为( )
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
13.下列各组物质汽化或熔化时,所克服的微粒间的作用力属同种类型的是( )
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石的熔化和冰的融化 |
10.下列有关物质分离说法正确的是( )
| A. | 乙酸乙酯与乙醇的分离可用分液操作 | |
| B. | 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水 | |
| C. | 碘酒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色 | |
| D. | 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法 |
7.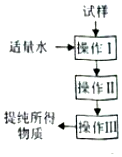 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
4.通过煤的气化和液化,使碳及其化合物得以广泛应用.
Ⅰ.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表.
则该温度下反应的平衡常数K=1.2.
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,
此时υ(正)< υ(逆)(填“>”“=”或“<”).
(3)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)?2N2O5(g);若已知K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1
(4)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(5)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:

一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
(6)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(7)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(8)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$ CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是,反应c中理论上原子利用率为100%.
Ⅰ.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,
此时υ(正)< υ(逆)(填“>”“=”或“<”).
(3)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)?2N2O5(g);若已知K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1
(4)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(5)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:

一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
(6)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(7)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(8)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$ CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是,反应c中理论上原子利用率为100%.
1.下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( )
| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |