题目内容
2.元素周期表共有七个周期,其中第一、二、三周期称为短周期,第四、五、六、七周期称为长周期,其中第七周期尚未填满,又可称作不完全周期.元素周期表中共有18个纵行,其中第8、9、10三个纵行称为第Ⅷ族;第18纵行由稀有气体元素组成,稀有气体元素的化学性质不活泼,化合价通常为0,因而这一族称为0族元素.分析 把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行称为周期,把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行称为族,元素周期表共有18个纵行,16个族,七个周期,周期表中1、2、3为短周期,4、5、6为长周期,第7周期为不完全周期.
解答 解:元素周期表有七个横行共有七个周期,其中1、2、3周期称为短周期,4、5、6、7周期称为 长周期,其中第七周期尚未填满,又可称作不完全周期.元素周期表中共有 18个纵列,其中第8、9、10三个纵列称为第Ⅷ族,第18纵列由稀有气体元素组成,稀有气体元素的化学性质不活泼,化合价通常为0,因而这一族称为0族元素,
故答案为:七;短;长;七;18; 第Ⅷ族; 0;0族元素.
点评 本题考查了元素周期表的结构,题目难度不大,侧重于基础知识的考查,注意把握周期和族的编排依据.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
2.下列实验操作与预期实验目的或所得实验结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
13.某二价阳离子含24个电子,它的质量数为59,则该离子核内中子数是( )
| A. | 22 | B. | 26 | C. | 33 | D. | 35 |
10.表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题.
(1)元素⑦在元素周期表位置是第三周期ⅣA族.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是 .
.
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是
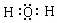 .
.(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.
17.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_{8}^{18}$O2.下列说法正确的是( )
| A. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O是中子数相同 | B. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O互为同位素 | ||
| C. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O化学性质不相同 | D. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O互为同素异形休 |
14.已知有关物质的熔、沸点数据如表:
请参考上述数据填空和完成问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
11.下列分散系能产生“丁达尔效应”的是( )
| A. | 稀硫酸 | B. | 硫酸铜溶液 | C. | 氢氧化铁胶体 | D. | 酒精溶液 |
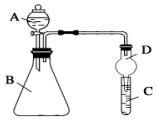 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.