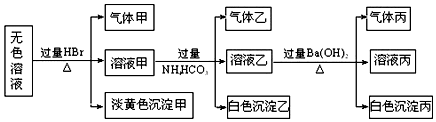
题目内容
17.请按要求回答如下有关大气污染处理的相关问题.(1)汽车发动机工作时常会产生NO2,其中主要反应的能量变化如图1所示:
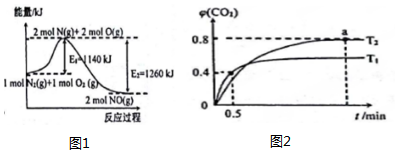
(1)①写出N2和O2反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1,.
②常温下NH3可与NO2直接反应实现无害转化.写出用此法治理n(NO):n(NO2)=1:1时反应(可逆)的化学方程式;已知该反应△H<0,写出既能加快反应速率又能提高氮氧化物的转化率的措施之一:其他条件不变,增大氨气的浓度.
(2)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容恒温密闭容器中通入2molCO,测得CO2的物质的量分数随时间t变化曲线如图2所示:
①T1温度下,0.5min内CO2的平均速率为0.8mol•L-1•min-1.
T2温度下,化学平衡常数K=1024.
②a点时,向容器中再冲入2molCO,再次达到平衡后,φ(CO2)不变(填“增大”、“减小”或“不变”
(3)利用I2消除SO2污染的工业流程如图:
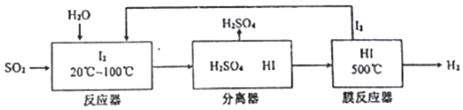
①反应器中反应的离子方程式:I2+SO2+2H2O=4H++2I-+SO42-.
②用化学平衡移动的原理分析,使用膜反应器及时分离出H2的目的是:碘化氢分解为可逆反应,及时分离出产物氢气,有利于反应正向进行,且生成更多的碘,有利于循环使用..
分析 (1)①氮气与氧气高温下反应生成一氧化氮,该反应中的反应热=反应物的键能和-生成物的键能和;
②依据题意n(NO):n(NO2)=1:1与氨气反应生成氮气和水,依据氧化还原反应得失电子守恒配平方程式;依据浓度对反应速率与化学平衡移动的影响解答;
(2)①根据CO起始量和0.5min末时CO2的体积分数(即物质量分数),列式计算即可求出从反应开始至0.5min末时的反应速率为v(CO2);根据a点时CO2的体积分数φ(CO2)求出CO和CO2的平衡浓度进而求出T2时化学平衡常数K;
②在定温、定容条件下,对反应前后气体分子数不变的可逆反应,只要反应物的物质的量之比与原平衡相同,则两平衡等效.两平衡中各组分的物质的量分数、气体体积分数、质量分数等对应相等;
(3)①二氧化硫与碘在酸性环境下发生氧化还原反应生成硫酸和碘化氢;
②碘化氢分解为可逆反应,依据浓度对化学平衡移动的影响解答.
解答 解:(1)①氮气与氧气高温下反应生成一氧化氮,该反应中的反应热=反应物的键能和-生成物的键能和=1140kJ/mol-1260kJ/mol=-120kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-120 kJ•mol-1,
故答案为:N2(g)+O2(g)=2NO(g)△H=-120 kJ•mol-1;
②依据题意n(NO):n(NO2)=1:1与氨气反应生成氮气和水,依据氧化还原反应得失电子守恒,反应的方程式:2NH3+NO2+NO?2N2+3H2O;增大反应物浓度可以提高反应速率,其他条件不变,增大氨气的浓度,2NH3+NO2+NO?2N2+3H2O平衡正向,移动二氧化氮、一氧化氮转化率提高;
故答案为:2NH3+NO2+NO?2N2+3H2O;其他条件不变,增大氨气的浓度;
(2)①0.5min时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol x x
a点量/mol 2-x x
根据a点时CO2的体积分数φ(CO2)=$\frac{x}{2}$=0.40,得x=0.8mol,则从反应开始至a点时的反应速率为v(CO2)=$\frac{\frac{0.8mol}{2L}}{0.5min}$=0.8mol•L-1•min-1;
T2时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol y y
b点量/mol 2-y y
根据a点时CO2的体积分数φ(CO2)=$\frac{y}{2}$=0.80,
得y=1.6mol,c(CO)=0.2mol•L-1,c(CO2)=0.8mol•L-1
T1时化学平衡常数K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$=$\frac{0.8{\;}^{5}}{0.2{\;}^{5}}$=1024,
故答案为:0.8mol•L-1•min-1;1024;
②在定温、定容条件下,5CO(g)+I2O5(s)?5CO2(g)+I2(s)反应前后气体系数和相等,向容器中再冲入2molCO,则与原平衡状态建立等比等效,两平衡中各组分的物质的量分数、气体体积分数相同,所以二氧化碳体积分数不变;
故答案为:不变;
(3)①二氧化硫与碘在酸性环境下发生氧化还原反应生成硫酸和碘化氢,反应的离子方程式:I2+SO2+2H2O=4H++2I-+SO42-;
故答案为:I2+SO2+2H2O=4H++2I-+SO42-;
②碘化氢分解为可逆反应,及时分离出产物氢气,相当于降低生成物浓度,化学平衡正向移动,生成的碘的物质的量增大,有利于循环使用;
故答案为:碘化氢分解为可逆反应,及时分离出产物氢气,有利于反应正向进行,且生成更多的碘,有利于循环使用.
点评 本题为综合题,考查了化学反应速率和化学平衡常数的相关计算、化学平衡移动原理,侧重于学生的分析能力和计算能力的考查,把握化学平衡常数的计算以及平衡移动的影响是解题关键,侧重于学生的分析能力和计算能力的考查,题目难度较大.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| 实验 | 向试管中加入2ml溶液 | 实验现象 |
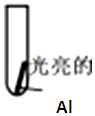 | 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
| 实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
①实验Ⅰ中生成红色物质的离子方程式为:2Al+3Cu2+=2Al3++3Cu
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:Cu2++2H2O?Cu(OH)2+2H+
③请写出60s后反应进一步加快可能的原因(写出两条)Cu和Al在酸性条件下形成原电池;反应放热,温度升高速率加快
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:Cl-对Al与Cu2+的置换反应存在促进作用
(3)为进一步研究上述假设,设计如下实验:
| 实验 | 向试管中加入2mL溶液 | 实验现象 |
 | 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
| 实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
| 实验Ⅵ:0.5mol/LCuSO4溶液+0.02mol NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:SO42-对Al与Cu2+的置换反应没有抑制作用
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:Cl-对Al与Cu2+的置换反应存在促进作用
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈.
| A. | 某放热反应能自发进行,因此该反应是熵增反应 | |
| B. | 用惰性电极电解含有 H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子 | |
| C. | 反应 A(g)?B(g)△H,若正反应的活化能为 EakJ/mol,逆反应的活化能为 EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| D. | 3x%的 A 物质的溶液与 x%的 A 物质的溶液等体积混合后溶液质量分数小于 2x%,则 A 可 能为乙醇 |
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向0.10mol•L-1氨水中通SO2:c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3) | |
| B. | 向0.10mol•L-1KHSO3溶液中通NH3:c(K+)>c(SO32-)>c(NH4+) | |
| C. | 向0.10mol•L-1NH4HS溶液中通H2S:c(NH4+)═c(S2-)+c(HS-) | |
| D. | 向0.10mol•L-1Na2C2O4溶液中通HCl:c(Cl-)═c(HC2O4-)+2c(H2C2O4) |
| A. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O是中子数相同 | B. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O互为同位素 | ||
| C. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O化学性质不相同 | D. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O互为同素异形休 |
 “化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.
“化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.