题目内容
12.用下列方法均可制得氧气:①2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl=3O2↑
②2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
④2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$O2↑+2H2O
若要制得相同质量的氧气,反应中电子转移数目之比为( )
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
分析 ①2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl=3O2↑
②2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑
③2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
④2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$O2↑+2H2O
制得相同质量的氧气,可假设得到3molO2,结合反应及转移的电子数计算.
解答 解:制得相同质量的氧气,可假设得到3molO2,则
①2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑~12e-;
3 12
②2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑~4e-;
3 12
③2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑~4e-;
3 12
④2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$O2↑+2H2O~2e-;
3 6
所以制得相同质量的氧气,反应中电子转移数目之比为12:12:12:6=2:2:2:1,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,侧重氧化还原反应电子转移的考查,注意电子守恒的应用,明确反应中元素的化合价变化即可解答,题目难度不大.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 2.3 gNa+中含有NA个电子 | |
| B. | 硫酸的摩尔质量与硫酸分子的质量相等 | |
| C. | NA个CC14分子在标准状况下的体积约为22.4 L | |
| D. | 18 g H2O中含有NA个H2、NA个O |
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3,2 | 6.0 | 6.5 | 7 |
②表格中几种氟化物熔点差异的主要原因是NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高
③1mol SiO2中含有4molSi-O键,Si和O原子配位数之比为2:1
④NaF、MgF2、MgO、SiF4、SiO2中化学键能够代表分子真实组成的是SiF4.
(2)
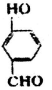 比
比 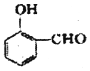 的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”). | 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素原子的核外p电子数比s电子数少1.C是电负性最大的元素.D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素.
已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素原子的核外p电子数比s电子数少1.C是电负性最大的元素.D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素.