题目内容
10.下列有关物质分离说法正确的是( )| A. | 乙酸乙酯与乙醇的分离可用分液操作 | |
| B. | 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水 | |
| C. | 碘酒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色 | |
| D. | 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法 |
分析 A.乙酸乙酯和乙醇混溶;
B.滴定管、容量瓶、分液漏斗带有活塞或旋塞,且由于盛装液体;
C.碘、酒精与四氯化碳混溶;
D.干馏发生复杂的化学变化.
解答 解:A.乙酸乙酯和乙醇混溶,不能用分液的方法分离,可蒸馏,故A错误;
B.滴定管、容量瓶、分液漏斗带有活塞或旋塞,且由于盛装液体,则在使用前均须冼净并检查是否漏水,故B正确;
C.碘、酒精与四氯化碳混溶,溶液不分层,故C错误;
D.干馏发生复杂的化学变化,不是利用沸点分离,如煤的干馏,故D错误.
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中分离方法为解答的关键,侧重分析与应用能力的考查,注意分离方法的选择,题目难度不大.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
1.(1)表是第三周期部分元素氧化物和氟化物的熔点和摩氏硬度:
①两种氧化物MgO和SiO2的晶体类型分别是离子晶体、原子晶体
②表格中几种氟化物熔点差异的主要原因是NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高
③1mol SiO2中含有4molSi-O键,Si和O原子配位数之比为2:1
④NaF、MgF2、MgO、SiF4、SiO2中化学键能够代表分子真实组成的是SiF4.
(2)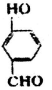 比
比 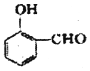 的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”).
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3,2 | 6.0 | 6.5 | 7 |
②表格中几种氟化物熔点差异的主要原因是NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高
③1mol SiO2中含有4molSi-O键,Si和O原子配位数之比为2:1
④NaF、MgF2、MgO、SiF4、SiO2中化学键能够代表分子真实组成的是SiF4.
(2)
 比
比  的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”).
5.以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性.
(1)对实验Ⅰ进行研究②④
①实验Ⅰ中生成红色物质的离子方程式为:2Al+3Cu2+=2Al3++3Cu
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:Cu2++2H2O?Cu(OH)2+2H+
③请写出60s后反应进一步加快可能的原因(写出两条)Cu和Al在酸性条件下形成原电池;反应放热,温度升高速率加快
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:Cl-对Al与Cu2+的置换反应存在促进作用
(3)为进一步研究上述假设,设计如下实验:
实验Ⅵ的设计目的是:对照实验,排除Na+的干扰,证明Na+对该反应不造成影响
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:SO42-对Al与Cu2+的置换反应没有抑制作用
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:Cl-对Al与Cu2+的置换反应存在促进作用
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈.
| 实验 | 向试管中加入2ml溶液 | 实验现象 |
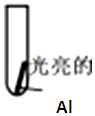 | 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
| 实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
①实验Ⅰ中生成红色物质的离子方程式为:2Al+3Cu2+=2Al3++3Cu
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:Cu2++2H2O?Cu(OH)2+2H+
③请写出60s后反应进一步加快可能的原因(写出两条)Cu和Al在酸性条件下形成原电池;反应放热,温度升高速率加快
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:Cl-对Al与Cu2+的置换反应存在促进作用
(3)为进一步研究上述假设,设计如下实验:
| 实验 | 向试管中加入2mL溶液 | 实验现象 |
 | 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
| 实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
| 实验Ⅵ:0.5mol/LCuSO4溶液+0.02mol NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:SO42-对Al与Cu2+的置换反应没有抑制作用
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:Cl-对Al与Cu2+的置换反应存在促进作用
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈.
15. 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
请按要求回答下列问题:
(1)X的单质的电子式: ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.
(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.
 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.| X | Y | |
| Z | W |
(1)X的单质的电子式:
 ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.
2.下列实验操作与预期实验目的或所得实验结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
9.工业上根据污水中所含物质或离子的不同,有多种处理方法:
请回答下列问题:
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
如图为化学沉淀法处理污水的工艺流程示意图.
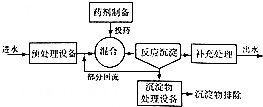
①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
| 污水中所含离子 | H+、OH- | CN- | Cu2+、Hg2+ |
| 处理方法 | 中和法 | 氧化还原法 | 沉淀法 |
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
| 物质 | Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| Ksp | 2.2×10-20 | 8.5×10 -45 | 6.3×10 -18 | 3.4×10-28 | 4×10-53 | 8×10-29 |

①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
10.表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题.
(1)元素⑦在元素周期表位置是第三周期ⅣA族.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是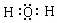 .
.
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是
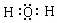 .
.(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.