题目内容
某化学兴趣小组按如图1所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.

(1)碳棒的电极反应式为 .
(2)②处白色棉球变为 色,③处白色棉球变为 色.
(3)④处棉球的作用是 .
(4)如图2X、Y两条线分别表示常见的非金属单质和金属单质(用M表示)与碳棒电解产物单质E在点燃条件下进行化合反应的物质的量之间的关系.写出符合Y线反应的化学方式 .
(5)在20℃时饱和食盐水的质量分数为26%,当阳极析出1.12L(标准状况下)气体时,Cl-完全放电.试计算要使溶液恢复原状态,需加入物质的化学式为 ,其质量为 g.

(1)碳棒的电极反应式为
(2)②处白色棉球变为
(3)④处棉球的作用是
(4)如图2X、Y两条线分别表示常见的非金属单质和金属单质(用M表示)与碳棒电解产物单质E在点燃条件下进行化合反应的物质的量之间的关系.写出符合Y线反应的化学方式
(5)在20℃时饱和食盐水的质量分数为26%,当阳极析出1.12L(标准状况下)气体时,Cl-完全放电.试计算要使溶液恢复原状态,需加入物质的化学式为
考点:电解原理
专题:电化学专题
分析:根据两极均有气体生成,说明铁是阴极电极反应:阴极(铁丝)2H++2e=H2↑,碳棒是阳极,阳极(碳棒):2Cl--2e=Cl2↑,再根据卤素间的置换及氯气的尾气处理解答;
(4)X线反应方程式为:M+Cl2═MCl2或者M2+Cl2═2MCl;Y线反应方程式为:2M+3Cl2═2MCl3,所以X、Y产物中元素化合价通常分别为:X线中若为M2,非金属M为+1、若为M,金属M显+2价,Y线金属+3价;
(5)根据电荷守恒进行有关电解计算.
(4)X线反应方程式为:M+Cl2═MCl2或者M2+Cl2═2MCl;Y线反应方程式为:2M+3Cl2═2MCl3,所以X、Y产物中元素化合价通常分别为:X线中若为M2,非金属M为+1、若为M,金属M显+2价,Y线金属+3价;
(5)根据电荷守恒进行有关电解计算.
解答:
解:(1)根据两极均有气体生成,说明铁是阴极电极反应:阴极(铁丝)2H++2e=H2↑,碳棒是阳极,阳极(碳棒):2Cl--2e=Cl2↑,故答案:2Cl--2e-=Cl2↑
(2)根据碳棒上产生氯气,氯气经过②处白色棉球时将溴置换出来呈橙黄色,经过,③处白色棉球时将碘置换出来遇淀粉呈蓝色;故答案:橙黄;蓝;
(3)④处棉球的作用尾气处理,主要是吸收未反应的氯气,防止其污染环境,故答案:吸收未反应的氯气,防止其污染环境;
(4)X线反应方程式为:M+Cl2═MCl2或者M2+Cl2═2MCl;Y线反应方程式为:2M+3Cl2═2MCl3,所以X、Y产物中元素化合价通常分别为:X线中若为M2,非金属M为+1、若为M,金属M显+2价,Y线金属+3价;故答案:2Fe+3Cl2
2FeCl3(或2Al+3Cl2
2AlCl3);
(5)设所取饱和食盐水质量为Xg
2NaCl Cl2
117g 22.4L
26%X 1.12L X=22.5
电解总反应:2NaCl+2H2O
Cl2↑+H2↑+2NaOH,从溶液中减少什么物质在复原时加入什么物质,因此应加入HCl,质量=1.12/22.4×2×36.5g=3.65g.
故答案:HCl;3.65
(2)根据碳棒上产生氯气,氯气经过②处白色棉球时将溴置换出来呈橙黄色,经过,③处白色棉球时将碘置换出来遇淀粉呈蓝色;故答案:橙黄;蓝;
(3)④处棉球的作用尾气处理,主要是吸收未反应的氯气,防止其污染环境,故答案:吸收未反应的氯气,防止其污染环境;
(4)X线反应方程式为:M+Cl2═MCl2或者M2+Cl2═2MCl;Y线反应方程式为:2M+3Cl2═2MCl3,所以X、Y产物中元素化合价通常分别为:X线中若为M2,非金属M为+1、若为M,金属M显+2价,Y线金属+3价;故答案:2Fe+3Cl2
| ||
| ||
(5)设所取饱和食盐水质量为Xg
2NaCl Cl2
117g 22.4L
26%X 1.12L X=22.5
电解总反应:2NaCl+2H2O
| ||
故答案:HCl;3.65
点评:氯气是一个重要的知识点,命题者设计出简洁的一器多用实验装置,并以装置图形式给考生呈现出来,将电解原理、氯气的性质和溴、碘单质的颜色、检验联系在一起.考查学生对所学知识的理解能力及对知识在新的情景下的迁移能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 |
| B、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,因此三氯化铁晶体是分子晶体 |
| C、Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 |
| D、SO2、H2O都是由极性键形成的非极性分子 |
下列关于铜的说法正确的是( )
| A、铜在干燥的空气中和在潮湿的空气中存在的形态相同 |
| B、相同质量的铜分别与足量的氯气、硫完全反应,失去的电子数相同 |
| C、相同物质的量的浓硫酸分别与足量的铜和氧化铜反应,生成硫酸铜的量相同 |
| D、相同质量的铜分别与足量的稀硝酸、浓硝酸完全反应,生成气体的物质的量不同 |
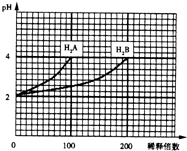 常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A、H2A为二元弱酸 |
| B、PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) |
| D、Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
25℃时,0.1mol/L的NaB溶液的pH=8,将该NaB溶液与0.06mol/L的盐酸等体积混合(混合时溶液体积变化忽略不计),下列说法中不正确的是( )
| A、混合溶液中:c(HB)+c(B-)=0.05mol/L |
| B、混合溶液中:c(OH-)+c(B-)-c(H+)=0.04mol/L |
| C、该NaB溶液中:c(H+)+c(HB)=1.0×10-6mol/L |
| D、该NaB溶液中:c(Na+)-c(B-)=9.9×10-7mol/L |
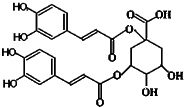 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )| A、分子中含有6个手性碳原子 |
| B、一定条件下能发生酯化反应和消去反应 |
| C、不能与氯化铁溶液发生显色反应 |
| D、1 mol洋蓟素最多可与11 mol NaOH反应 |
下列各选项中所述的两个量,前者一定大于后者的是( )
| A、pH=10的NaOH和Na2CO3溶液中,水的电离程度 |
| B、物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度 |
| C、将pH=3的盐酸和醋酸分别加水稀释成pH=5的溶液,所加水的量 |
| D、相同温度下,10mL 0.1mol?L-1的醋酸和100mL 0.01mol?L-1的醋酸中H+物质的量 |
下列叙述错误的是( )
| A、蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物 |
| B、氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、合金材料中可能含有非金属元素 |