题目内容
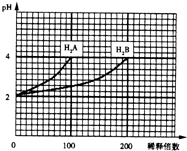 常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A、H2A为二元弱酸 |
| B、PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) |
| D、Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据图象知,H2A溶液稀释100倍,溶液pH由2增至4,说明H2A是强酸;而H2B溶液稀释200倍,溶液PH增加2个单位,说明H2B为弱酸;
B.溶液中存在电离平衡:HA-=H++A2-,不存在H2A、HA-;
C.根据NaHA和NaHB的混合液中的物料守恒分析;
D.H2B是弱酸,其钠盐水溶液呈碱性,根据盐的水解原理判断溶液中离子浓度大小.
B.溶液中存在电离平衡:HA-=H++A2-,不存在H2A、HA-;
C.根据NaHA和NaHB的混合液中的物料守恒分析;
D.H2B是弱酸,其钠盐水溶液呈碱性,根据盐的水解原理判断溶液中离子浓度大小.
解答:
解:A.pH=2的H2A稀释100倍时溶液的pH变为4,说明该酸完全电离,所以为强酸,其电离方程式为H2A═2H++A2-,故A错误;
B.pH=4的NaHA水溶液中存在NaHA=Na++H++A2-、H2O?H++OH-,所以溶液呈存在粒子浓度大小顺序是c(H+)>c(Na+)=c(A2-)>c(OH-)>c(H2A),故B错误;
C.NaHA中的物料守恒为:c(Na+)=c(A2-)+c(H+),NaHB中的物料守恒为:c(Na+)=c(HB-)+c(H2B)+c(B2-),二者结合可得:c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-)+c(H+),故C错误;
D.H2B为弱酸,所以Na2B的水溶液中,B2-两步电离生成氢氧根离子,但水解程度较小,钠离子不水解,导致溶液呈碱性,则溶液中离子浓度大小顺序是c(Na+)>c(B2-)>c(OH-)>c(HB-)>c(H+),故D正确;
故选D.
B.pH=4的NaHA水溶液中存在NaHA=Na++H++A2-、H2O?H++OH-,所以溶液呈存在粒子浓度大小顺序是c(H+)>c(Na+)=c(A2-)>c(OH-)>c(H2A),故B错误;
C.NaHA中的物料守恒为:c(Na+)=c(A2-)+c(H+),NaHB中的物料守恒为:c(Na+)=c(HB-)+c(H2B)+c(B2-),二者结合可得:c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-)+c(H+),故C错误;
D.H2B为弱酸,所以Na2B的水溶液中,B2-两步电离生成氢氧根离子,但水解程度较小,钠离子不水解,导致溶液呈碱性,则溶液中离子浓度大小顺序是c(Na+)>c(B2-)>c(OH-)>c(HB-)>c(H+),故D正确;
故选D.
点评:本题考查了弱电解质的电离、离子浓度大小比较,题目难度中等,根据图象确定酸的强弱是解本题关键,再结合守恒思想分析解答,易错选项为C,注意明确:如果两种溶质的物质的量浓度相等,则存在c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-),该题未确定溶质关系,导致无法确定离子浓度关系.

练习册系列答案
相关题目
下列有关实验原理或操作正确的是( )
A、 选择合适的试剂,装置可分别制取少量CO2、NO和O2 |
B、 洗涤沉淀时(如图),向漏斗中加适量水,搅拌并滤干 |
| C、制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |
| D、用广泛pH试纸测得0.10 mol?L-1 NH4Cl溶液的pH=5.2 |
某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用.A的结构简式如图下列有关A的叙述中正确的是( )


| A、A的分子式为:C14H13O5N2 |
| B、A可以发生水解反应、中和反应、加成反应、消去反应 |
| C、A物质完全水解的产物中,一定含有醇类 |
| D、在一定条件下,1molA最多能与1L 2mol?L-1NaOH溶液反应 |
 为探究SO2气体的还原性某兴趣小组设计了如装置图:
为探究SO2气体的还原性某兴趣小组设计了如装置图:

