题目内容
下列说法正确的是( )
| A、在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 |
| B、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,因此三氯化铁晶体是分子晶体 |
| C、Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 |
| D、SO2、H2O都是由极性键形成的非极性分子 |
考点:原子核外电子排布,极性分子和非极性分子,不同晶体的结构微粒及微粒间作用力的区别
专题:原子组成与结构专题,化学键与晶体结构
分析:A、对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断;
B、熔沸点低的晶体一般属于分子晶体;
C、Na3N和水反应生成氢氧化钠,NaH和水反应生成氢氧化钠,无色酚酞试液遇碱变红色;
D、SO2中含S=O极性键,为V型分子,属于极性分子,H2O中含H-O极性键,为V型分子,属于极性分子.
B、熔沸点低的晶体一般属于分子晶体;
C、Na3N和水反应生成氢氧化钠,NaH和水反应生成氢氧化钠,无色酚酞试液遇碱变红色;
D、SO2中含S=O极性键,为V型分子,属于极性分子,H2O中含H-O极性键,为V型分子,属于极性分子.
解答:
解:A、PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构,故A错误;
B、三氯化铁常温下为固体,熔点282℃,沸点315℃,熔沸点低为分子晶体,故B正确;
C、氮化钠和水反应生成氢氧化钠和氨气,氢化钠和水反应生成氢氧化钠和氢气,所以反应后的溶液都呈碱性,无色酚酞试液遇碱变红色,故C正确;
D、SO2中含S=O极性键,为V型分子,属于极性分子,H2O中含H-O极性键,为V型分子,属于极性分子,故D错误;
故选BC.
B、三氯化铁常温下为固体,熔点282℃,沸点315℃,熔沸点低为分子晶体,故B正确;
C、氮化钠和水反应生成氢氧化钠和氨气,氢化钠和水反应生成氢氧化钠和氢气,所以反应后的溶液都呈碱性,无色酚酞试液遇碱变红色,故C正确;
D、SO2中含S=O极性键,为V型分子,属于极性分子,H2O中含H-O极性键,为V型分子,属于极性分子,故D错误;
故选BC.
点评:本题考查较综合,涉及化学键和晶体的考查,把握化学键的形成及晶体的判断、晶体熔沸点的比较、分子极性的判断等为解答的关键,注重高频考点的考查,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
在核外电子排布如下的原子中,有最高化合价且其值最大的是( )
| A、1S22S22P2 |
| B、1S22S22P63S23P6 |
| C、1S22S22P5 |
| D、1S22S22P63S23P1 |
下列原子或离子的基态电子排布式正确的是( )
| A、Ni:[Ar]3d8 |
| B、Cu:[Ar]3d94s2 |
| C、S2-:[Ne]2s23p6 |
| D、Si:[Ne]3s23p2 |
下列有关实验原理或操作正确的是( )
A、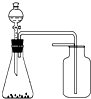 选择合适的试剂,装置可分别制取少量CO2、NO和O2 |
B、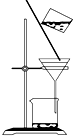 洗涤沉淀时(如图),向漏斗中加适量水,搅拌并滤干 |
| C、制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |
| D、用广泛pH试纸测得0.10 mol?L-1 NH4Cl溶液的pH=5.2 |
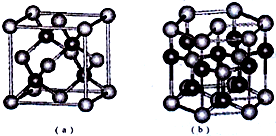 已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满.请根据以上信息,回答下列问题:
已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满.请根据以上信息,回答下列问题: