题目内容
下列各选项中所述的两个量,前者一定大于后者的是( )
| A、pH=10的NaOH和Na2CO3溶液中,水的电离程度 |
| B、物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度 |
| C、将pH=3的盐酸和醋酸分别加水稀释成pH=5的溶液,所加水的量 |
| D、相同温度下,10mL 0.1mol?L-1的醋酸和100mL 0.01mol?L-1的醋酸中H+物质的量 |
考点:pH的简单计算,水的电离
专题:电离平衡与溶液的pH专题
分析:A.氢氧化钠为强碱溶液,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的;碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子为水电离的;
B.硝酸铵是强电解质完全电离,氨水是弱碱部分电离;
C.HCl是强电解质、醋酸是弱电解质,加水稀释促进醋酸电离;
D.醋酸为弱电解质,溶液浓度越大,电离程度越小.
B.硝酸铵是强电解质完全电离,氨水是弱碱部分电离;
C.HCl是强电解质、醋酸是弱电解质,加水稀释促进醋酸电离;
D.醋酸为弱电解质,溶液浓度越大,电离程度越小.
解答:
解:A.25℃时,pH值都等于10的NaOH溶液中,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,水电离的氢离子为:1×10-10mol/L;pH=10的碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,水电离的氢离子浓度为:
=10-4mol/L,所以Na2CO3溶液中水电离程度>NaOH溶液中水的电离程度,故A错误;
B.硝酸铵是强电解质完全电离,少量铵根离子水解生成一水合氨和氢离子,氨水属于弱电解质,不完全电离,所以物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度前者大于后者,故B正确;
C.HCl是强电解质、醋酸是弱电解质,存在电离平衡,稀释促进电离,要都稀释到pH=5,则加入的水要多余盐酸的,所以等pH=3的盐酸和醋酸加水稀释成pH=5的溶液,所加水的量前者小于后者,故C错误;
D.由n=cV可知,10mL 0.1mol/L的醋酸溶液中溶质的物质的量为0.001mol,100mL0.01mol/L的醋酸溶液中溶质的物质的量为0.001mol,但前者的浓度大,醋酸的电离程度小,所以氢离子的物质的量前者小于后者,故D错误;
故选B.
| 1×10-14 |
| 1×10-10 |
B.硝酸铵是强电解质完全电离,少量铵根离子水解生成一水合氨和氢离子,氨水属于弱电解质,不完全电离,所以物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度前者大于后者,故B正确;
C.HCl是强电解质、醋酸是弱电解质,存在电离平衡,稀释促进电离,要都稀释到pH=5,则加入的水要多余盐酸的,所以等pH=3的盐酸和醋酸加水稀释成pH=5的溶液,所加水的量前者小于后者,故C错误;
D.由n=cV可知,10mL 0.1mol/L的醋酸溶液中溶质的物质的量为0.001mol,100mL0.01mol/L的醋酸溶液中溶质的物质的量为0.001mol,但前者的浓度大,醋酸的电离程度小,所以氢离子的物质的量前者小于后者,故D错误;
故选B.
点评:本题考查了弱电解质的电离及其影响因素,题目难度中等,注意明确电解质的电离平衡及影响电离的因素,明确酸溶液、碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
已知0.1mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是( )
A、将该溶液加水稀释,
| ||
| B、加入少量KOH固体,钠离子和碳酸根离子浓度均增大 | ||
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | ||
| D、c(Na+)=c(HCO3- )+2c(CO32-)+c(H2CO3) |
已知:乙醇可被强氧化剂氧化为乙酸. 可经三步反应制取
可经三步反应制取  ,发生反应的类型依次是( )
,发生反应的类型依次是( )
 可经三步反应制取
可经三步反应制取  ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O→HBr+HIO,下列有关IBr的叙述中,不正确的是( )
| A、在很多反应中IBr是强氧化剂 |
| B、IBr与水反应时既做氧化剂,又做还原剂 |
| C、IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D、IBr与NaOH溶液反应时,生成NaBr和NaIO |
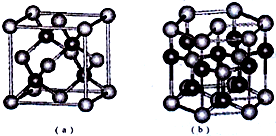 已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满.请根据以上信息,回答下列问题:
已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满.请根据以上信息,回答下列问题: