题目内容
12.已知Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,某化学兴趣小组为探究SO2的性质,按图所示装置进行实验.请回答下列问题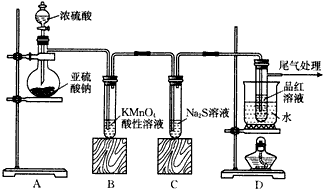
(1)装置A中盛放浓硫酸的仪器名称是分液漏斗
(2)实验过程中,装置B的现象分别是溶液由紫红色变为无色C中无色溶液出现黄色浑浊,这些现象分别说明SO2具有的性质是还原性和氧化性.(填A.氧化性 B.还原性 C.漂白性)
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
(4)尾气可采用NaOH溶液吸收,其中发生反应的化学方程式为2NaOH+SO2=Na2SO3+H2O.
分析 (1)依据仪器形状说出其名称;
(2)依据二氧化硫的还原性、氧化性解答;
(3)根据二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色来解答;
(4)二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应生成亚硫酸钠和水,可以采用氢氧化钠溶液吸收尾气.
解答 解:(1)依据仪器形状可知装置A中盛放浓硫酸的仪器名称为分液漏斗;
故答案为:分液漏斗;
(2)二氧化硫具有还原性,能够还原酸性的高锰酸钾,使高锰酸钾褪色,B的现象分别是溶液由紫红色变为无色;二氧化硫具有氧化性,能氧化硫离子生成单质硫,C中无色溶液出现黄色浑浊;
故答案为:溶液由紫红色变为无色;还原性;氧化性;
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
故答案为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色;
(4)二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式:2NaOH+SO2=Na2SO3+H2O,可以采用氢氧化钠溶液吸收尾气;
故答案为:NaOH;2NaOH+SO2=Na2SO3+H2O.
点评 本题为实验习题,考查二氧化硫的制取及二氧化硫的性质实验,明确反应原理、二氧化硫的性质是解答本题的关键,难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
16.常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 3A(g)+2B(s)?2C(g)+D(g)△H=-a kJ/mol.5min后达平衡,测得容器中n(C)=0.8mol.则下列说法正确的是( )
| A. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| B. | 该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 使用催化剂或缩小容器体积,该平衡均不会移动 |
17.维生素C又称“抗坏血酸”,能将人体不易吸收的Fe3+转化为Fe2+,这说明维C是( )
| A. | 电解质 | B. | 氧化剂 | C. | 还原剂 | D. | 胶体 |
14.将V1ml 1.00mol/LHCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50ml),下列叙述正确的是( )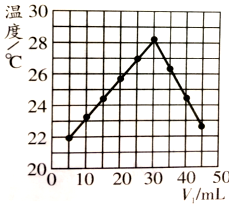

| A. | 实验操作时的环境温度为22℃ | |
| B. | 实验表明热能可转化为化学能 | |
| C. | 该实验表明有水生成的反应都是放热反应 | |
| D. | NaOH溶液的浓度约为1.50 mol/L |
1.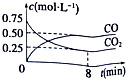 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)下列措施中能使平衡时K增大的是B(填序号).
A.升高温度B.增大压强C.充入一定量COD.降低温度
(3)8分钟内,CO2的平均反应速率v(CO2)=0.0625mol•L-1•min-1.
(4)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①下列说法正确的是AB.
A.p1<p2 B.φ1=φ2 C.2c1=3c2 D.α1=α2
②求c1=0.67mol•L-1、α2=33.3%.
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)下列措施中能使平衡时K增大的是B(填序号).
A.升高温度B.增大压强C.充入一定量COD.降低温度
(3)8分钟内,CO2的平均反应速率v(CO2)=0.0625mol•L-1•min-1.
(4)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、 2mol CO2 | 4mol FeO、 3mol CO |
| CO的浓度(mol•L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
A.p1<p2 B.φ1=φ2 C.2c1=3c2 D.α1=α2
②求c1=0.67mol•L-1、α2=33.3%.
2.低温脱硝技术可用于处理废气中的氮氧化物,
发生的化学反应为:2NH3(g)+NO(g)+NO2(g)$?_{催化剂}^{180℃}$2N2(g)+3H2O(g) 正反应放热在恒容的密闭容器中,下列有关说法正确的是( )
发生的化学反应为:2NH3(g)+NO(g)+NO2(g)$?_{催化剂}^{180℃}$2N2(g)+3H2O(g) 正反应放热在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度平衡正向移动 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
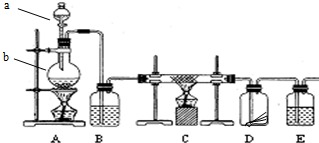
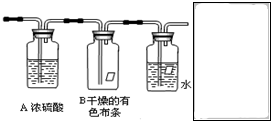 某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题: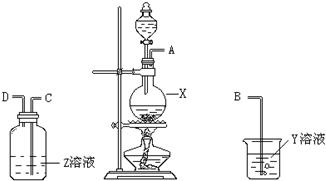 某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.