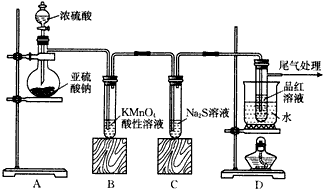
题目内容
16.常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 3A(g)+2B(s)?2C(g)+D(g)△H=-a kJ/mol.5min后达平衡,测得容器中n(C)=0.8mol.则下列说法正确的是( )| A. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| B. | 该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 使用催化剂或缩小容器体积,该平衡均不会移动 |
分析 A.速率之比等于化学计量数之比;
B.物质的量与反应中热量变化成正比;
C.升高温度,速率增大,平衡逆向移动;
D.该反应为气体体积不变的反应.
解答 解:A.速率之比等于化学计量数之比,A、C的化学计量数之比为3:2,则2v(A)=3v(C),故A错误;
B.物质的量与反应中热量变化成正比,该可逆反应达平衡后,转化的A为1.2mol,则放出的热量为$\frac{1.2×a}{3}$kJ=0.4kJ,故B错误;
C.升高温度,正逆反应速率增大,平衡逆向移动,故C错误;
D.该反应为气体体积不变的反应,则使用催化剂或缩小容器体积,该平衡均不会移动,故D正确;
故选D.
点评 本题考查化学平衡移动,为高频考点,把握化学平衡移动的影响因素为解答的关键,侧重分析与应用能力的考查,注意温度、压强对平衡移动的影响,选项B为易错点,题目难度不大.

练习册系列答案
相关题目
7.低温脱硝技术可用于处理废气中的氮氧化物发生的化学反应为:2NH3(g)+NO(g)+NO2(g)$?_{催化剂}^{180℃}$
2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加 NH3 的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗 NO 和 N2 的物质的量比为 1:2 时,反应达到平衡 |
4.在容积固定的密闭容器中,对于反应2SO2(g)+O2(g)?2SO3(g)△H<0.下列判断正确的是( )
| A. | 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加 | |
| B. | 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态 | |
| C. | 充入SO3气体,体系压强增大,平衡向右移动 | |
| D. | 升高温度,平衡向左移动 |
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1 mol羟基与1 mol氢氧根离子所含的电子数均为9NA | |
| B. | 常温下,44 g N2O和CO2组成的混合气体,所含原子数为3NA | |
| C. | 0.1 mol/L的NaClO溶液,含有的阴离子数为0.1NA | |
| D. | 常温下,将 1 mol Fe投入过量浓硝酸中,转移的电子数为3NA |
5.下列可以大量共存且形成无色溶液的一组离子应该是( )
| A. | Ag+、Cu2+、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
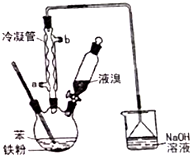 溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去)
溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去) +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.
+HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体. ,(3)MgO
,(3)MgO .
.