题目内容
2.下列说法正确的是( )| A. | pH=6的NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| B. | 等物质的量浓度的NH3•H2O溶液和NH4Cl溶液等体积混合后所得的溶液中,2c(OH-)+c(NH3•H2O)=2c(H+)+c(NH4+) | |
| C. | 等体积、等物质的量浓度的 Na2CO3溶液与 NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(H+)=c(OH-) |
分析 A.NaHSO3溶液中pH=6,说明HSO3-电离程度大于水解程度,导致溶液呈酸性;
B.等物质的量浓度的NH3•H2O溶液和NH4Cl溶液等体积混合,NH3•H2O电离程度大于NH4+水解程度,溶液呈碱性,根据电荷守恒和物料守恒判断;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.二者反应生成硫酸钠、硫酸铵和水,硫酸铵溶液呈酸性,要使混合溶液呈中性,则NH4HSO4、NaOH的物质的量之比小1:2,结合物料守恒判断.
解答 解:A.NaHSO3溶液中pH=6,说明HSO3-电离程度大于水解程度,导致溶液呈酸性,则c(H2SO3)<c(SO32-),故A错误;
B.等物质的量浓度的NH3•H2O溶液和NH4Cl溶液等体积混合,NH3•H2O电离程度大于NH4+水解程度,溶液呈碱性,根据电荷守恒得c(OH-)+c(Cl-)=c(H+)+c(NH4+)
根据物料守恒得c(NH4+)+c(NH3•H2O)=2c(Cl-),
所以得2c(OH-)+c(NH3•H2O)=2c(H+)+c(NH4+)
故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故C错误;
D.二者反应生成硫酸钠、硫酸铵和水,硫酸铵溶液呈酸性,要使混合溶液呈中性,NH4HSO4、NaOH的物质的量之比小1:2,中性溶液中存在c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(NH4+)=2c(SO42-),因为c(Na+)>c(SO42-),则c(NH4+)<(SO42-),
所以离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用,难点是D选项中离子浓度比较,可以采用逆向思维方法进行判断,题目难度中等.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | ZnCl2溶液 | B. | NaCl溶液 | C. | CaCl2溶液 | D. | FeCl3溶液 |
| A. | 若增大压强,平衡向正方向移动,平衡常数变大 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015mol/L | |
| C. | 达到平衡时X浓度为0.04 mol/L | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
| A. | 1.2 mol | B. | 1.5 mol | C. | 1.8 mol | D. | 2.1 mol |
| A. | 金属钠存放在盛有煤油的试剂瓶中 | |
| B. | 烧碱盛放在玻璃瓶塞的磨口玻璃瓶中 | |
| C. | 存放液溴的试剂瓶中应加水封 | |
| D. | 漂白粉置于冷暗处密封保存 |
| A. | NO2是红棕色气体,易溶于水,不是酸性氧化物 | |
| B. | NO可以用排水法收集,但不能由N2和O2直接化合而得到 | |
| C. | NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物 | |
| D. | NO、NO2都有毒,且NO是汽车尾气的有害成分之一 |
| A. | 2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| B. | 2Fe2++4I-+4Br-+5Cl2═2Fe3++2I2+2Br2+10Cl- | |
| C. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- | |
| D. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
| A. | 64g/mol | B. | 32g/mol | C. | 16g | D. | 8g |
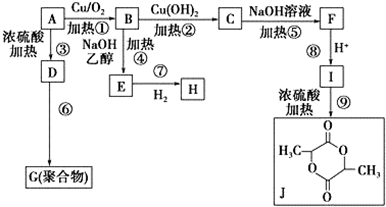
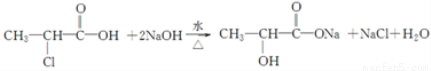 .
.