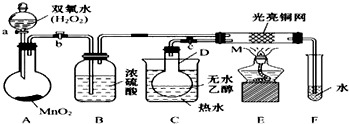
题目内容
13.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)═Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )| A. | 若增大压强,平衡向正方向移动,平衡常数变大 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015mol/L | |
| C. | 达到平衡时X浓度为0.04 mol/L | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
分析 A.平衡常数只随温度的变化而变化;
B.由于前后气体计量数之和不相等,容积增大,压强减小,化学平衡向逆反应方向移动;
C.根据生成的Z的量求出转化的X的量,再求出平衡时X的浓度;
D.升高温度化学平衡向吸热的方向移动,X的体积分数增大说明平衡逆向进行.
解答 解:A.平衡常数只随温度的变化而变化,所以若增大压强,则平衡常数不变,故A错误;
B.容积增大为20L,压强减小为原来的一半,如果平衡不移动则Z浓度变为原来的 $\frac{1}{2}$,但是压强减小时,平衡向左移动,Z浓度小于原来的 $\frac{1}{2}$,即Z的平衡浓度小于0.015mol/L,故B错误;
C.经60s达到平衡,生成0.3mol Z,则消耗的X为0.6mol,所以达到平衡时X浓度为 $\frac{(1mol-0.6mol)}{10L}$=0.04 mol/L,故C正确;
D.若升高温度,X的体积分数增大,说明向逆反应方向移动,故逆反应吸热,则正反应方向为放热,故△H<0,故D错误;
故选C.
点评 本题主要考查化学平衡移动的影响因素,根据反应物浓度、压强、温度等因素对平衡移动的影响,可以做出准确的判断,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.下列说法正确的是( )
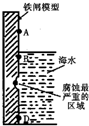

| A. | 该过程发生了析氢腐蚀 | |
| B. | 铁单质被直接氧化生成Fe3+ | |
| C. | B点附近会生成最多的铁锈 | |
| D. | 在铁闸上镶嵌一些铜片可以减缓海水对铁闸的腐蚀 |
4.已建立化学平衡的某可逆反应,当改变条件使平衡向正反应方向移动,正确的是( )
| A. | 生成物的百分含量一定增加 | B. | 正反应速率大于逆反应速率 | ||
| C. | 反应物的转化率一定增大 | D. | 反应物浓度一定降低 |
1.下列关系式中,正确的是( )
| A. | 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍 |
18. 恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )
恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )
 恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )
恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )| A. | x+y>z+m | |
| B. | 对反应体系加压v正>v逆 | |
| C. | 该反应正反应方向为热反应 | |
| D. | 对反应体系降低温度达平衡前v逆>v正 |
5. 为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知
为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知  是不稳定的].
是不稳定的].
 为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知
为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知  是不稳定的].
是不稳定的].| A. | 2 种 | B. | 3种 | C. | 1种 | D. | 4种 |
2.下列说法正确的是( )
| A. | pH=6的NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| B. | 等物质的量浓度的NH3•H2O溶液和NH4Cl溶液等体积混合后所得的溶液中,2c(OH-)+c(NH3•H2O)=2c(H+)+c(NH4+) | |
| C. | 等体积、等物质的量浓度的 Na2CO3溶液与 NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(H+)=c(OH-) |
3.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 氢氧化铁胶体 | B. | 盐酸 | C. | 氯化钠溶液 | D. | 蔗糖溶液 |