题目内容
11.向FeI2和FeBr2、氯气的物质的量之比为1:1:2的混合溶液中,发生的离子反应是( )| A. | 2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| B. | 2Fe2++4I-+4Br-+5Cl2═2Fe3++2I2+2Br2+10Cl- | |
| C. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- | |
| D. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
分析 Cl2既可氧化I-为I2,也可氧化Br-为Br2,也可氧化Fe2+为Fe3+,因还原性I->Fe2+>Br-,所以通入氯气,首先氧化I-,然后氧化Fe2+,最后氧化Br-,以此来解答.
解答 解:氧化还原反应中:氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,因还原性I->Fe2+>Br-,所以通入氯气,首先氧化I-,然后氧化Fe2+,最后氧化Br-,
FeI2和FeBr2、氯气的物质的量之比为1:1:2,由电子守恒可知,氯气得到电子为2×2=4,碘离子失去电子为1×2=2,则亚铁离子全部被氧化,所以发生的离子反应为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-,
故选D.
点评 本题考查氧化还原反应及离子反应方程式书写,为高频考点,把握还原性的强弱及氧化的先后顺序为解答的关键,侧重分析与应用能力的考查,注意电子守恒应用,题目难度不大.

练习册系列答案
相关题目
1.下列关系式中,正确的是( )
| A. | 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍 |
2.下列说法正确的是( )
| A. | pH=6的NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| B. | 等物质的量浓度的NH3•H2O溶液和NH4Cl溶液等体积混合后所得的溶液中,2c(OH-)+c(NH3•H2O)=2c(H+)+c(NH4+) | |
| C. | 等体积、等物质的量浓度的 Na2CO3溶液与 NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(H+)=c(OH-) |
19.下列式子表示的物质一定为纯净物的是( )
| A. | C2H6O | B. | CH4O | C. | C2H4O2 | D. | C7H16 |
16.碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验.
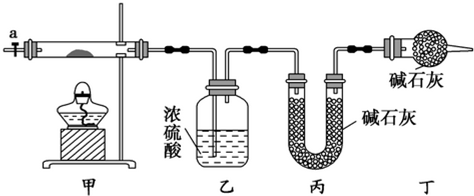
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通入空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的D(填字母)连接在活塞a前(或装置甲前)(填装置连接位置).

(4)若按正确装置进行实验,测得如下数据:
则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:
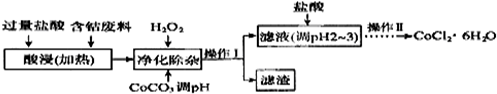
已知:
①净除杂质时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整PH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.

(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通入空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的D(填字母)连接在活塞a前(或装置甲前)(填装置连接位置).

(4)若按正确装置进行实验,测得如下数据:
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
| 开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整PH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
3.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 氢氧化铁胶体 | B. | 盐酸 | C. | 氯化钠溶液 | D. | 蔗糖溶液 |
20.25℃时,将V1L PH=a 的NaOH溶液和V2L PH=b 的盐酸溶液混合后,溶液呈中性.若a+b>14,则V1/V2的值为( )
| A. | 10a+b-14 | B. | 1014-a-b | C. | 1014+a-b | D. | 10a+b+14 |