题目内容
下述实验方案能达到实验目的是( )
| 编号 | A | B | C | D |
| 实验 方案 |
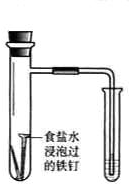 食盐水 |
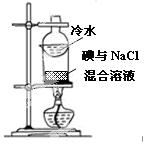 |
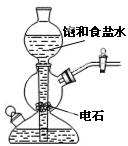 |
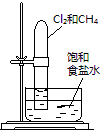 置于光亮处 |
| 实验 目的 |
验证铁钉发生析氢腐蚀 | 从碘与NaCl混合溶液中分离出碘 | 实验室制备乙炔 | 验证甲烷与氯气发生化学反应 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,金属的电化学腐蚀与防护,乙炔炔烃,物质的分离、提纯的基本方法选择与应用,甲烷的取代反应
专题:实验评价题
分析:A.食盐水为中性,发生吸氧腐蚀;
B.应用萃取的方法分离;
C.不能用启普发生器制备乙炔;
D.甲烷与氯气发生取代反应生成HCl,试管中液面上升.
B.应用萃取的方法分离;
C.不能用启普发生器制备乙炔;
D.甲烷与氯气发生取代反应生成HCl,试管中液面上升.
解答:
解:A.食盐水为中性,发生吸氧腐蚀,而酸性溶液中发生析氢腐蚀,故A错误;
B.加热溶液,不能使碘升华,应用萃取的方法分离,故B错误;
C.反应放热、迅速,且生成的氢氧化钙浊液易堵塞玻璃管,不能用启普发生器制备乙炔,故C错误;
D.甲烷与氯气发生取代反应生成HCl,试管中液面上升,实验装置可验证甲烷与氯气发生了化学反应,故D正确;
故选D.
B.加热溶液,不能使碘升华,应用萃取的方法分离,故B错误;
C.反应放热、迅速,且生成的氢氧化钙浊液易堵塞玻璃管,不能用启普发生器制备乙炔,故C错误;
D.甲烷与氯气发生取代反应生成HCl,试管中液面上升,实验装置可验证甲烷与氯气发生了化学反应,故D正确;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及电化学腐蚀、电解原理、常见有机物性质等,把握物质的性质及实验装置图的作用、反应原理为解答的关键,注意实验方案的评价性、操作性分析,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度 |
B、如图,一段时间后给烧杯内地溶液中加入黄色的K3[Fe(CN)6]溶液,可看到Fe电极附近有蓝色沉淀生成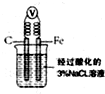 |
| C、用标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
| D、用加热的方式可提取NH4Cl固体中混有的少量的碘 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
下列化学用语不能正确解释相关事实的是( )
| A、碱性氢氧燃料电池的正极反应:H2-2e-+2OH-═2H2O | ||||
B、用电子式表示NaCl的形成过程: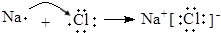 | ||||
| C、向含有Hg2+的废水中加入Na2S可除去Hg2+:Hg2++S2-═HgS↓ | ||||
D、汽车尾气系统的催化转化器可降低NO等的排放:2CO+2NO
|
下列说法中,不正确的是( )
| A、恒容密闭容器中进行反应:2A2(g)+B2(g)?2A2B(g);△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 |
| B、在常温下,用惰性电极电解饱和Na2CO3溶液,Na2CO3溶液的浓度不变 |
| C、使用催化剂能够改变反应历程,增大反应物分子的接触面积,从而加快反应速率 |
| D、放热或熵增过程自发进行的可能性比吸热或熵减过程要大 |
 现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.
现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5. 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.