题目内容
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.
请回答下列问题.
(1)元素D在周期表中的位置 .
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) .
(3)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: .
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: ,冶炼金属E时,用石墨做电极.E在(填“阴”或“阳”) 极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是 .
(5)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有 .土壤中含有X中的阳离子在硝化细菌的催化作用下被氧气氧化为其阴离子,写出其离子方程式: .
请回答下列问题.
(1)元素D在周期表中的位置
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)
(3)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:
(5)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则C是O元素;C与F同主族,则F是S元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,据此解答.
解答:
解:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则C是O元素;C与F同主族,则F是S元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,
(1)D是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以其在元素周期表中的位置是第三周期第IA族,
故答案为:第三周期第IA族;
(2)电子层数越多离子半径越大,电子层结构相同,核电荷数越大离子半径越小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是:S 2->O 2->Na+,
故答案为:S 2->O 2->Na+;
(3)若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SO3 2-+H2O,
故答案为:SiO2+2OH-=SO3 2-+H2O;
(4)若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应,反应方程式为:2Al+Fe2O3
Al2O3+2Fe,冶炼金属Al时,铝离子发生还原反应得到Al,故用石墨做电极,Al在阴极极得到,电解过程中,阳极反应:2O2--4e-=O2↑,碳与O2反应消耗碳,故阳极石墨需要不断补充,
故答案为:2Al+Fe2O3
Al2O3+2Fe;阴;阳极反应:2O2--4e-=O2↑,碳与O2反应消耗碳;
(5)由H、N、O三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有离子键和共价键,土壤中含有NH4NO3中的阳离子在硝化细菌的催化作用下被氧气氧化为其阴离子,即得到硝酸根,根据电荷守恒应有氢离子生成,其离子方程式为:NH4++2O2
NO3-+H2O+2H+,
故答案为:离子键、共价键;NH4++2O2
NO3-+H2O+2H+.
(1)D是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以其在元素周期表中的位置是第三周期第IA族,
故答案为:第三周期第IA族;
(2)电子层数越多离子半径越大,电子层结构相同,核电荷数越大离子半径越小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是:S 2->O 2->Na+,
故答案为:S 2->O 2->Na+;
(3)若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SO3 2-+H2O,
故答案为:SiO2+2OH-=SO3 2-+H2O;
(4)若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应,反应方程式为:2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
(5)由H、N、O三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有离子键和共价键,土壤中含有NH4NO3中的阳离子在硝化细菌的催化作用下被氧气氧化为其阴离子,即得到硝酸根,根据电荷守恒应有氢离子生成,其离子方程式为:NH4++2O2
| ||
故答案为:离子键、共价键;NH4++2O2
| ||
点评:本题考查结构性质位置关系应用,推断元素是解题关键,综合考查学生分析能力、逻辑推理能力及对知识的迁移运用,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
下列装置能达到实验目的是( )


| A、除去乙醇中的苯酚 |
| B、制取金属锰 |
| C、实验室制氨气 |
| D、从碘的CCl4溶液中分离I2 |
青霉素是一元有机酸,它的钠盐的1国际单位的质量为6.00×10-7克,它的钾盐1国际单位的质量为6.27×10-7克,(1国际单位的2种盐的物质的量相等),则青霉素的相对分子质量为( )
| A、371.6 |
| B、355.6 |
| C、333.6 |
| D、332.6 |
下述实验方案能达到实验目的是( )
| 编号 | A | B | C | D |
| 实验 方案 |
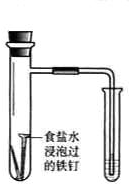 食盐水 |
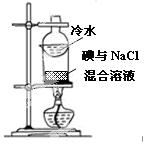 |
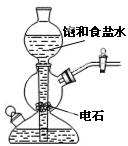 |
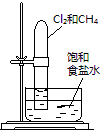 置于光亮处 |
| 实验 目的 |
验证铁钉发生析氢腐蚀 | 从碘与NaCl混合溶液中分离出碘 | 实验室制备乙炔 | 验证甲烷与氯气发生化学反应 |
| A、A | B、B | C、C | D、D |
元素周期表中短周期元素W、X、Y、Z,原子序数依次增大,液态的单质W是火箭起飞的重要燃料;X原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z原子在同周期中原子半径最小(除稀有气体外).下列说法错误的是( )
| A、元素W与元素X形成的含有共价键的化合物只有一种 |
| B、元素X的单质与元素Y的单质反应时,反应条件不同,产物也不同 |
| C、元素Y与元素W可以原子个数比为1:1的化合物甲,且甲与水反应有气体产生 |
| D、元素Z的单质与元素W.Y的单质都能反应,且反应中Z的单质都做氧化剂 |
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是H2SO4溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
| A、蓄电池放电时,电路中每转移2mol电子,最多有1mol PbO2被还原 |
| B、电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C、电解后,c(Na2SO4)不变,且溶液中有晶体析出 |
| D、蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O |
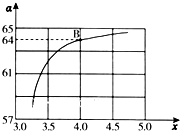 氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用. 通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.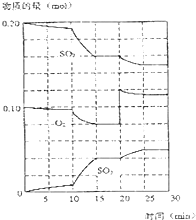 在一定条件下,二氧化碳和氧气发生如下反应:
在一定条件下,二氧化碳和氧气发生如下反应: