题目内容
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据Na2O和Na2O2的构成分析;
B.Fe与Cl2反应生成氯化铁,每生成1mol氯化铁转移电子3mol;
C.标准状况下,三氯甲烷是液态,不能使用气体摩尔体积22.4L/mol;
D.氮气和氢气合成氨是可逆反应.
B.Fe与Cl2反应生成氯化铁,每生成1mol氯化铁转移电子3mol;
C.标准状况下,三氯甲烷是液态,不能使用气体摩尔体积22.4L/mol;
D.氮气和氢气合成氨是可逆反应.
解答:
解:A.1molNa2O能电离出1mol氧离子,1molNa2O2能电离出1mol过氧根离子,Na2O和Na2O2的混合物共1mol,阴离子数目为NA,故A正确;
B.Fe与Cl2反应生成氯化铁,每生成1mol氯化铁转移电子3mol,生成0.1mol氯化铁时失去的电子数为0.3NA,故B错误;
C.标准状况下,三氯甲烷是液态,不能使用气体摩尔体积22.4L/mol,故C错误;
D.氮气和氢气合成氨是可逆反应,不能进行彻底,2mol H2和0.5mol N2充分反应后可得到NH3分子数小于NA,故D错误;
故选A.
B.Fe与Cl2反应生成氯化铁,每生成1mol氯化铁转移电子3mol,生成0.1mol氯化铁时失去的电子数为0.3NA,故B错误;
C.标准状况下,三氯甲烷是液态,不能使用气体摩尔体积22.4L/mol,故C错误;
D.氮气和氢气合成氨是可逆反应,不能进行彻底,2mol H2和0.5mol N2充分反应后可得到NH3分子数小于NA,故D错误;
故选A.
点评:本题考查常用化学计量的有关计算,难度不大,注意公式的运用.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列说法正确的是( )
| A、常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | ||
| B、铁片镀锌时,铁片与外电源的正极相连 | ||
| C、NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | ||
D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,
|
下述实验方案能达到实验目的是( )
| 编号 | A | B | C | D |
| 实验 方案 |
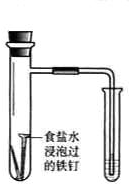 食盐水 |
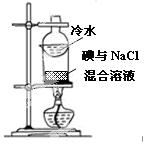 |
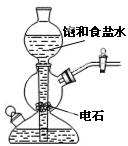 |
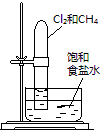 置于光亮处 |
| 实验 目的 |
验证铁钉发生析氢腐蚀 | 从碘与NaCl混合溶液中分离出碘 | 实验室制备乙炔 | 验证甲烷与氯气发生化学反应 |
| A、A | B、B | C、C | D、D |
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg═Cu2HgI4+2Cu.下列说法中正确的是( )
| A、该反应的氧化剂为CuI,氧化产物为Cu |
| B、产物Cu2HgI4中,Cu元素的化合价为+2 |
| C、当有2mol CuI参与反应时,转移电子为1mol |
| D、由Cu2+与I直接反应制得CuI的离子方程式为Cu2++I-=CuI |
元素周期表中短周期元素W、X、Y、Z,原子序数依次增大,液态的单质W是火箭起飞的重要燃料;X原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z原子在同周期中原子半径最小(除稀有气体外).下列说法错误的是( )
| A、元素W与元素X形成的含有共价键的化合物只有一种 |
| B、元素X的单质与元素Y的单质反应时,反应条件不同,产物也不同 |
| C、元素Y与元素W可以原子个数比为1:1的化合物甲,且甲与水反应有气体产生 |
| D、元素Z的单质与元素W.Y的单质都能反应,且反应中Z的单质都做氧化剂 |
已知X、Y是元素周期表中前20号元素,二者原子序数相差3,X、Y能形成化台物M,下列说法正确的是( )
| A、若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 |
| B、若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性 |
| C、若M属于离子化合物,则该化合物中只存在离子键 |
| D、若M属于共价化台物,则该分子中原子个数比可能为1:2 |
 一定条件下,尿素[CO(NH2)2]与NO反应生成N2和另外2种对环境无污染的氧化物.如图是CO(NH2)2与某种烟气中NO的物质的量之比分别为1:2、2:1、3:1时,NO脱除率随温度(t)变化的图象.下列说法错误的是( )
一定条件下,尿素[CO(NH2)2]与NO反应生成N2和另外2种对环境无污染的氧化物.如图是CO(NH2)2与某种烟气中NO的物质的量之比分别为1:2、2:1、3:1时,NO脱除率随温度(t)变化的图象.下列说法错误的是( )| A、尿素脱除NO的反应为:2CO(NH2)2+6NO═2CO2+4H2O+5N2 |
| B、图中a,对应CO(NH2)2与NO的物质的量之比为1:2 |
| C、在900℃左右,NO的脱除率最佳 |
| D、NO的起始浓度为6×10-4mg/m3,图中a从A点到B点经过0.8s,这段时间内NO的脱除平均速率为1.5×10-4mg/(m3?s) |
 已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:
已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)?B(g)+C(g);△H=-48.25kJ/L时间t与A、B的浓度有如图所示关系,若测得第15min时c(B)=1.6mol/L,则下列结论正确的是( )
| A、该温度下此反应平衡常数为3.2 | ||
| B、A的初始物质的量为4 mol | ||
| C、0-15min内,气体密度不变 | ||
D、要使
|
 通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.