题目内容
下列陈述Ⅰ和Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| B | SO2有氧化性 | SO2尾气可用NaOH溶液吸收 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | NH3和HCl在水中溶解度很大 | 充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升 |
| A、A | B、B | C、C | D、D |
考点:浓硫酸的性质,氨的物理性质,二氧化硫的化学性质,金属冶炼的一般原理
专题:氧族元素,氮族元素,几种重要的金属及其化合物
分析:A.浓硫酸能干燥酸性或中性气体,但不能干燥碱性气体,也不能干燥硫化氢等还原性气体;
B.二氧化硫属于酸性氧化物,能被碱溶液吸收;
C.活泼金属采用电解熔融盐或氧化物的方法冶炼;
D.极易溶于该溶液的气体能形成喷泉实验.
B.二氧化硫属于酸性氧化物,能被碱溶液吸收;
C.活泼金属采用电解熔融盐或氧化物的方法冶炼;
D.极易溶于该溶液的气体能形成喷泉实验.
解答:
解:A.氨气属于碱性气体,能和浓硫酸反应生成硫酸铵,所以不能干燥氨气,故A错误;
B.二氧化硫属于酸性氧化物,能被氢氧化钠溶液吸收生成亚硫酸钠,与二氧化硫的氧化性无关,故B错误;
C.活泼金属采用电解熔融盐或氧化物的方法冶炼,Mg属于活泼金属,应该采用熔融氯化镁的方法冶炼,故C错误;
D.极易溶于该溶液的气体能形成喷泉实验,氯化氢和氨气都极易溶于水,所以能形成喷泉实验,故D正确;
故选D.
B.二氧化硫属于酸性氧化物,能被氢氧化钠溶液吸收生成亚硫酸钠,与二氧化硫的氧化性无关,故B错误;
C.活泼金属采用电解熔融盐或氧化物的方法冶炼,Mg属于活泼金属,应该采用熔融氯化镁的方法冶炼,故C错误;
D.极易溶于该溶液的气体能形成喷泉实验,氯化氢和氨气都极易溶于水,所以能形成喷泉实验,故D正确;
故选D.
点评:本题考查了干燥剂的选取、金属的冶炼、喷泉实验的形成条件等知识点,明确物质的性质是解本题关键,再结合物质的性质分析解答,金属冶炼方法的选取、喷泉实验等知识点是高考高频点,要熟练掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、可用使铁钝化的方法来减缓铁的腐蚀 |
| B、除去CO气体中的少量氧气可让气体通过加热的铜网 |
| C、不论将铝箔加热到什么样的温度均是只熔化而不滴落下来 |
| D、等质量的铝与盐酸或氢氧化钠溶液反应时产生的氢气体积一定相等 |
下述实验方案能达到实验目的是( )
| 编号 | A | B | C | D |
| 实验 方案 |
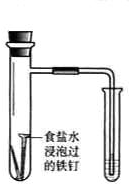 食盐水 |
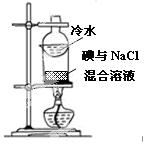 |
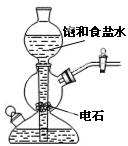 |
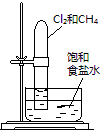 置于光亮处 |
| 实验 目的 |
验证铁钉发生析氢腐蚀 | 从碘与NaCl混合溶液中分离出碘 | 实验室制备乙炔 | 验证甲烷与氯气发生化学反应 |
| A、A | B、B | C、C | D、D |
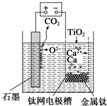 如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )
如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )| A、阳极反应式为C+2O2--4e-═CO2↑ |
| B、由TiO2制得1mol金属Ti,理论上外电路转移4mol电子 |
| C、制备金属钛前后,装置中CaO的量不变 |
| D、TiO2在阴极放电 |
元素周期表中短周期元素W、X、Y、Z,原子序数依次增大,液态的单质W是火箭起飞的重要燃料;X原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z原子在同周期中原子半径最小(除稀有气体外).下列说法错误的是( )
| A、元素W与元素X形成的含有共价键的化合物只有一种 |
| B、元素X的单质与元素Y的单质反应时,反应条件不同,产物也不同 |
| C、元素Y与元素W可以原子个数比为1:1的化合物甲,且甲与水反应有气体产生 |
| D、元素Z的单质与元素W.Y的单质都能反应,且反应中Z的单质都做氧化剂 |
下列说法正确的是( )
| A、所谓低碳经济,是指在可持续发展理念指导下,尽可能地减少光化学污染气体的排放 |
| B、汽油、柴油和植物油都是碳氢化合物 |
| C、只由一种元素组成的物质,一定是纯净物 |
| D、化学反应的实质就是旧化学键的断裂、新化学键形成过程 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、能与Cu反应产生气体的溶液:Na+、Fe2+、Cl-、SO42- |
| B、滴入甲基橙显红色的溶液:K+、Cu2+、NO3-、I- |
| C、由水电离出的C(H+)?C(OH-)═10-24溶液:K+、Na+、NO3-、Cl- |
| D、无色溶液:K+、Al3+、ClO-、SO42- |
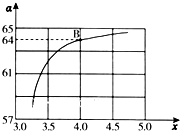 氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.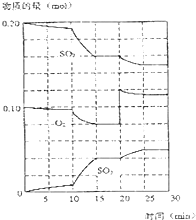 在一定条件下,二氧化碳和氧气发生如下反应:
在一定条件下,二氧化碳和氧气发生如下反应: