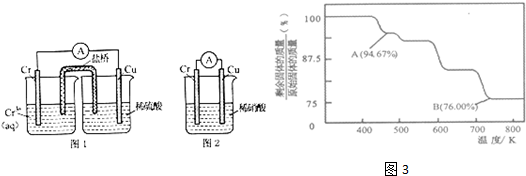
题目内容
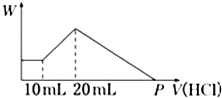 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:(1)混合物中NaOH的质量为
(2)P点表示盐酸的体积是
考点:有关混合物反应的计算
专题:计算题
分析:(1)由生成沉淀的质量关系图可知,滴加的前10mL稀盐酸,没有影响沉淀的量,说明滴加的稀盐酸在与混合物中剩余的氢氧化钠发生反应;继续滴加稀盐酸时,沉淀量增加,此时稀盐酸与NaAlO2发生反应产生Al(OH)3沉淀;此后再滴加的稀盐酸与氢氧化铝和氢氧化镁的沉淀发生反应,直至Mg(OH)2和Al(OH)3沉淀全部溶解;综合以上分析,混合物中的氢氧化钠溶于水后与氯化镁、氯化铝发生反应后还有剩余,剩余的氢氧化钠与稀盐酸发生反应;固体物中的氯化铝与氢氧化钠反应生成NaAlO2;因此,计算出的质量就可以根据反应的化学方程式计算氯化铝的质量;
(2)P点为全部反应完全反应后所消耗稀盐酸的量,需要计算出氢氧化铝、氢氧化镁两种沉淀物完全溶解所消耗稀盐酸的量.
(2)P点为全部反应完全反应后所消耗稀盐酸的量,需要计算出氢氧化铝、氢氧化镁两种沉淀物完全溶解所消耗稀盐酸的量.
解答:
解:(1)从图中可以看出,Mg(OH)2的质量为0.58 g,即0.01 mol,根据反应:MgCl2+2NaOH═2NaCl+Mg(OH)2↓,
m(MgCl2)=0.01 mol×95 g?mol-1=0.95 g,生成氢氧化镁沉淀消耗氢氧化钠的物质的量为:n1(NaOH)=2n[Mg(OH)2]=0.02 mol;
开始至加入10 mL盐酸,发生反应:NaOH+HCl═NaCl+H2O,
剩余的氢氧化钠的物质的量为:n2(NaOH)=n(HCl)=0.5 mol?L-1×10×10-3L=5×10-3 mol,
盐酸的加入量从10~20 mL 发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
n(NaAlO2)=n(HCl)=0.5 mol?L-1×(20-10)×10-3L=0.005 mol,
根据反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
氢氧化钠生成偏铝酸钠消耗的氢氧化钠的物质的量为:n3(NaOH)=4n(NaAlO2)=0.02 mol,
m(AlCl3)=0.005 mol×133.5 g?mol-1=0.6675g,
m(NaOH)=(0.02 mol+5×10-3mol+0.02 mol)×40g/mol=1.8g;
故答案为:1.8g;0.6675;0.95g;
(2)根据反应:Al(OH)3+3HCl═AlCl3+3H2O,
Mg(OH)2+2HCl═MgCl2+2H2O
n(HCl)=0.005 mol×3+0.01 mol×2=0.035 mol
V(HCl)=
=70mL,
P点加入盐酸的体积为20mL+70mL=90mL,
故答案为:90.
m(MgCl2)=0.01 mol×95 g?mol-1=0.95 g,生成氢氧化镁沉淀消耗氢氧化钠的物质的量为:n1(NaOH)=2n[Mg(OH)2]=0.02 mol;
开始至加入10 mL盐酸,发生反应:NaOH+HCl═NaCl+H2O,
剩余的氢氧化钠的物质的量为:n2(NaOH)=n(HCl)=0.5 mol?L-1×10×10-3L=5×10-3 mol,
盐酸的加入量从10~20 mL 发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
n(NaAlO2)=n(HCl)=0.5 mol?L-1×(20-10)×10-3L=0.005 mol,
根据反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
氢氧化钠生成偏铝酸钠消耗的氢氧化钠的物质的量为:n3(NaOH)=4n(NaAlO2)=0.02 mol,
m(AlCl3)=0.005 mol×133.5 g?mol-1=0.6675g,
m(NaOH)=(0.02 mol+5×10-3mol+0.02 mol)×40g/mol=1.8g;
故答案为:1.8g;0.6675;0.95g;
(2)根据反应:Al(OH)3+3HCl═AlCl3+3H2O,
Mg(OH)2+2HCl═MgCl2+2H2O
n(HCl)=0.005 mol×3+0.01 mol×2=0.035 mol
V(HCl)=
| 0.035mol |
| 0.5mol/L |
P点加入盐酸的体积为20mL+70mL=90mL,
故答案为:90.
点评:本题考查了有关离子反应的计算,题目难度中等,根据滴加稀盐酸与产生沉淀的关系图,分析各阶段所发生的反应,利用各阶段反应的化学方程式进行相关物质质量的计算;本题所涉及的反应比较复杂,在分析时逐个反应梳理清楚是解决本问题的关键.

练习册系列答案
相关题目
向某浓度的铬酸(H2CrO4)溶液中滴加氢氧化钠溶液时,各粒子浓度(mol?L-1 )与pH的关系如下表,下列说法不正确的是( )
| pH | c(CrO42-) | c(HCrO4-) | c(Cr2O72-) | c(H2CrO4) |
| 4 | 0.0003 | 0.1030 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0899 | 0.4370 | 0 |
| 7 | 0.2645 | 0.0860 | 0.3195 | 0 |
| 9 | 0.8960 | 0.0031 | 0.0004 | 0 |
| A、铬酸的第一步电离方程式为:H2CrO4=H++HCrO4- |
| B、该铬酸溶液的物质的量浓度约为1.00mol/L |
| C、pH越大,HCrO4-越容易电离出CrO42- |
| D、NaHCrO4溶液中:c(OH-)>c(H+) |
在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:下列说法中正确的是( )
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A、反应开始20s内二氧化氮的平均反应速率是0.001mol?L-1 |
| B、80s时混合气体的颜色与60s时颜色相同,比40s时的颜色深 |
| C、80s时向容器内加0.32molHe,同时将容器扩大为4L,则平衡不移动 |
| D、若起始投料为0.20molN2O4相同条件下达到平衡,则各组分的含量与原平衡相同 |
甲、乙、丙、丁四种物质分别含2种或3种元素,它们的分子中各含18个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断不合理的是( )
| A、某钠盐溶液含甲电离出的阴离子,则该溶液显碱性且能与酸反应 |
| B、乙与氧气的摩尔质量相同,则乙可能是N2H4或CH3OH |
| C、丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物 |
| D、丁和甲中各元素质量比相同,则丁中一定含有-1价的元素 |
关于下列四个图象的说法中正确的是( ) 

| A、图①t1时改变的条件可能是升高了温度或增大了压强 |
| B、图②该微粒仅为18O2-不能为16O2- |
| C、图③若A为CaO,则B可能为MgO |
| D、图④中的△H1<△H2 |


 和
和 也可以发生类似反应①的反应,反应后有机产物的结构简式为
也可以发生类似反应①的反应,反应后有机产物的结构简式为