题目内容
甲、乙、丙、丁四种物质分别含2种或3种元素,它们的分子中各含18个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断不合理的是( )
| A、某钠盐溶液含甲电离出的阴离子,则该溶液显碱性且能与酸反应 |
| B、乙与氧气的摩尔质量相同,则乙可能是N2H4或CH3OH |
| C、丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物 |
| D、丁和甲中各元素质量比相同,则丁中一定含有-1价的元素 |
考点:无机物的推断
专题:
分析:A.甲是18电子的气态氢化物,在水中分步电离出两种阴离子,则其水溶液为二元弱酸,不难得出甲为H2S;
B.乙与氧气的摩尔质量相同,可能为CH3 OH、N2H4等;
C.丙中含有二周期IVA族的元素,可能为CH3 OH等;
D.丁和甲中各元素质量比相同,丁应为H2O2.
B.乙与氧气的摩尔质量相同,可能为CH3 OH、N2H4等;
C.丙中含有二周期IVA族的元素,可能为CH3 OH等;
D.丁和甲中各元素质量比相同,丁应为H2O2.
解答:
解:A.甲是18电子的氢化物,且其水溶液为二元弱酸,不难得出甲为H2S,若盐溶液为Na2S溶液,溶液呈碱性,若为NaHS,其溶液呈碱性,都能与酸反应,故A合理;
B.氧气的摩尔质量为32g/mol,乙的摩尔质量也为32g/mol,且含有18电子,可能为CH3 OH、N2H4,故B合理;
C.丙中含有第二周期IVA族元素为C,如CH3OH符合,但CH3OH不是CH4的同系物,故C不合理;
D.H2S中元素的质量比为1:16,H2O2分子中元素的质量比也为1:16,则丁为H2O2,H2O2中氧元素的价态为-1价,故D合理.
故选:C.
B.氧气的摩尔质量为32g/mol,乙的摩尔质量也为32g/mol,且含有18电子,可能为CH3 OH、N2H4,故B合理;
C.丙中含有第二周期IVA族元素为C,如CH3OH符合,但CH3OH不是CH4的同系物,故C不合理;
D.H2S中元素的质量比为1:16,H2O2分子中元素的质量比也为1:16,则丁为H2O2,H2O2中氧元素的价态为-1价,故D合理.
故选:C.
点评:本题考查无机物的推断,中等难度,注意常见18电子物质的种类以及性质,解答本题时注意能找出反例.

练习册系列答案
相关题目
下列说法正确的是( )
| A、地壳中含量最多的元素是铝元素 |
| B、在自然界中钠以化合态存在 |
| C、铁在自然界中主要以铁单质的形式存在 |
| D、铁是金属元素,其单质在空气中不能燃烧 |
在密闭容器中发生反应:aX(g)+bY(g)?cZ(g)+dW(g)当反应达到平衡后,保持温度不变,将气体压缩到原来的
体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述中不正确的是( )
| 1 |
| 2 |
| A、平衡向逆反应方向移动 |
| B、a+b>c+d |
| C、Z的体积分数减小 |
| D、X的转化率减小 |
在标准状况下,将aLNH3完全溶于水得到VmL氨水,所得溶质的物质的量浓度为c mol/L.下列叙述中不正确的是( )
A、C=
| ||
B、已知常温下,氨水的电离常数为Ka,则pH约等于14+lg
| ||
| C、上述溶液中再加入0.5VmL同浓度稀盐酸,充分反应后c(Cl-)=c(NH4+)+c(NH3?H2O) | ||
| D、上述溶液中再加入VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
下列有关元素及其化合物知识说法正确的是( )
| A、在常温下铜与浓硝酸反应,说明硝酸只有氧化性 |
| B、铵盐加热都能分解,但不一都能生成氨气 |
| C、工业上用反应Na+KCl=NaCl+K 制取金属钾,说明钠的还原性强于钾 |
| D、溴中溶有少量的碘,可以用酒精萃取的方法提纯 |
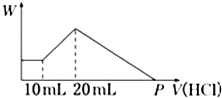 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示: