题目内容
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题:
(1)请写出该实验的实验步骤
① ,② ,③ ,④ ,⑤ .
(2)为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至溶量瓶定容.对所配溶液浓度的影响: (填“偏高”“偏低”或“不变”),原因是: .
(1)请写出该实验的实验步骤
①
(2)为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至溶量瓶定容.对所配溶液浓度的影响:
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)依据用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀;
(2)在未降至室温时,立即将溶液转移至溶量瓶定容,冷却后溶液的体积变小,依据C=
分析.
(2)在未降至室温时,立即将溶液转移至溶量瓶定容,冷却后溶液的体积变小,依据C=
| n |
| V |
解答:
解:(1)用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀;
故答案为:计算;称量;溶解转移;洗涤转移;定容摇匀;
(2)未降至室温时,立即将溶液转移至容量瓶定容.溶液热胀冷缩,恢复到室温后溶液体积小于500mL,浓度偏高,
故答案为:偏高;恢复到室温后溶液体积小于500mL.
故答案为:计算;称量;溶解转移;洗涤转移;定容摇匀;
(2)未降至室温时,立即将溶液转移至容量瓶定容.溶液热胀冷缩,恢复到室温后溶液体积小于500mL,浓度偏高,
故答案为:偏高;恢复到室温后溶液体积小于500mL.
点评:本题考查一定体积一定物质的量浓度溶液的配制,明确配制原理和一般步骤是解题关键,注意误差分析的方法.

练习册系列答案
相关题目
正丁醛经催化加氢可制备1-丁醇.为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
粗品
滤液
有机层
1-丁醇、乙醚
纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
粗品
| 饱和NaHSO3溶液 |
| 操作1 |
| 乙醚 |
| 萃取操作2 |
| 固体干燥剂 |
| 操作3 |
| 操作4 |
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
| A、过滤、分液、过滤、蒸馏 |
| B、萃取、过滤、蒸馏、蒸馏 |
| C、过滤、蒸馏、过滤、蒸馏 |
| D、过滤、分液、蒸馏、萃取 |
下列有关元素及其化合物知识说法正确的是( )
| A、在常温下铜与浓硝酸反应,说明硝酸只有氧化性 |
| B、铵盐加热都能分解,但不一都能生成氨气 |
| C、工业上用反应Na+KCl=NaCl+K 制取金属钾,说明钠的还原性强于钾 |
| D、溴中溶有少量的碘,可以用酒精萃取的方法提纯 |
下列叙述正确的是( )
| A、工业上用电解熔融氯化铝和冰晶石的混合物的方法得到铝 |
| B、一次电池是最常见的化学电源,一次电池中发生氧化还原反应的物质大部分被消耗后就不能再使用,铅蓄电池是最常见的一次电池 |
| C、氯碱工业中,氢氧化钠在电解槽的阴极区产生 |
| D、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
关于氧化剂的叙述正确的是( )
| A、分子中不一定含有氧元素 |
| B、分子中一定含有氧元素 |
| C、在反应中有元素化合价升高 |
| D、在反应中有元素化合价降低 |
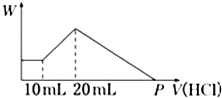 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示: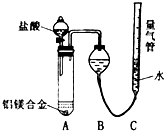 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.