题目内容
在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:下列说法中正确的是( )
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A、反应开始20s内二氧化氮的平均反应速率是0.001mol?L-1 |
| B、80s时混合气体的颜色与60s时颜色相同,比40s时的颜色深 |
| C、80s时向容器内加0.32molHe,同时将容器扩大为4L,则平衡不移动 |
| D、若起始投料为0.20molN2O4相同条件下达到平衡,则各组分的含量与原平衡相同 |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:由表中数据,60s、80s时四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.3,n2=0.07,n3=n4=0.24,
A.根据v=
计算v(NO2);
B.二氧化氮的浓度越大,混合气体颜色越深;
C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同.
A.根据v=
| ||
| △t |
B.二氧化氮的浓度越大,混合气体颜色越深;
C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同.
解答:
解:由表中数据,60s、80s是四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.3,n2=0.07,n3=n4=0.24,
A.v(NO2)=
=0.0025 mol/(L?s),故A错误;
B.60s、80s时处于平衡状态,故颜色一样,但比40s时二氧化氮的浓度低,颜色比40s浅,故B错误;
C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动,即向生成二氧化氮的方向移动,故C错误;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同,故各组分的含量与原平衡相同,故D正确,
故选:D.
A.v(NO2)=
| ||
| 20S |
B.60s、80s时处于平衡状态,故颜色一样,但比40s时二氧化氮的浓度低,颜色比40s浅,故B错误;
C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动,即向生成二氧化氮的方向移动,故C错误;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同,故各组分的含量与原平衡相同,故D正确,
故选:D.
点评:本题考查化学反应速率计算、化学平衡影响因素、等效平衡等,难度不大,C选项为易错点,注意总压强不变但反应混合气体的分压减小,相当于降低压强.

练习册系列答案
相关题目
将下列四种铁的化合物分别溶于稀盐酸,滴加KSCN溶液颜色没有变化,再加入新制氯水即呈红色的是( )
| A、FeO |
| B、Fe2O3 |
| C、Fe3O4 |
| D、Fe2(SO4)3 |
正丁醛经催化加氢可制备1-丁醇.为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
粗品
滤液
有机层
1-丁醇、乙醚
纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
粗品
| 饱和NaHSO3溶液 |
| 操作1 |
| 乙醚 |
| 萃取操作2 |
| 固体干燥剂 |
| 操作3 |
| 操作4 |
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
| A、过滤、分液、过滤、蒸馏 |
| B、萃取、过滤、蒸馏、蒸馏 |
| C、过滤、蒸馏、过滤、蒸馏 |
| D、过滤、分液、蒸馏、萃取 |
在密闭容器中发生反应:aX(g)+bY(g)?cZ(g)+dW(g)当反应达到平衡后,保持温度不变,将气体压缩到原来的
体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述中不正确的是( )
| 1 |
| 2 |
| A、平衡向逆反应方向移动 |
| B、a+b>c+d |
| C、Z的体积分数减小 |
| D、X的转化率减小 |
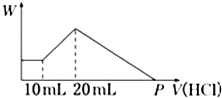 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示: