题目内容
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
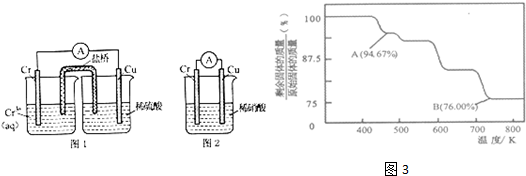
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体.根据上述现象试推测金属铬的两个重要化学性质,由图 1 知 、由图 2 知 .
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为: .
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如3图所示.
①A 点时剩余固体的成分是 (填化学式).
②从开始加热到 750K 时总反应方程式为 .
(4)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31].
①电解过程中 NaCI 的作用是 .
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol?L-1,则溶液中c(Cr3+)为_ _ mol?L-1.

(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体.根据上述现象试推测金属铬的两个重要化学性质,由图 1 知
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为:
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如3图所示.
①A 点时剩余固体的成分是
②从开始加热到 750K 时总反应方程式为
(4)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31].
①电解过程中 NaCI 的作用是
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol?L-1,则溶液中c(Cr3+)为_
考点:难溶电解质的溶解平衡及沉淀转化的本质,氧化还原反应,原电池和电解池的工作原理
专题:
分析:(1)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,能和稀硫酸反应生成 H2;而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr和硝酸能产生钝化现象;
(2)根据化合价升降总数相等以及原子守恒来解答;
(3)①根据质量守恒定律,在变化过程中,Cr的质量没有变,求出氧原子和铬原子的个数比即可;
②先求出B的固体的成分,再利用原子守恒写出方程式;
(4)①NaCl为电解质,加入适量的NaCl可增强溶液的导电能力;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+).
(2)根据化合价升降总数相等以及原子守恒来解答;
(3)①根据质量守恒定律,在变化过程中,Cr的质量没有变,求出氧原子和铬原子的个数比即可;
②先求出B的固体的成分,再利用原子守恒写出方程式;
(4)①NaCl为电解质,加入适量的NaCl可增强溶液的导电能力;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+).
解答:
解:(1)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,能和稀硫酸反应生成 H2;而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr和硝酸能产生钝化现象,
故答案为:金属铬的活动性比铜强,能和稀硫酸反应生成 H2;金属铬易被稀硝酸钝化;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O,
故答案为:4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O;
(3)①设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×
=52g,A点时固体的质量为:100g×94.67%=94.67g,Co的质量没有变,所以生成物中Co的质量为52g,氧元素的质量为42.67g,两者的个数比为
:
=3:8,所以A点时剩余固体的成分是Cr3O8,故答案为:Cr3O8;
②B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为
:
=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,则反应方程式为:4CrO3
2Cr2O3+3O2↑,
故答案为:4CrO3
2Cr2O3+3O2↑;
(4)①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强溶液的导电能力;
②溶液中c(OH-)=
=
mol/L=
mol/L,则溶液中c(Cr3+)=
=
=3.0×10ˉ6mol/L,
故答案为:3.0×10ˉ6.
故答案为:金属铬的活动性比铜强,能和稀硫酸反应生成 H2;金属铬易被稀硝酸钝化;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O,
故答案为:4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O;
(3)①设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×
| 52 |
| 52+16×3 |
| 52 |
| 52 |
| 42.67 |
| 16 |
②B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为
| 52 |
| 52 |
| 24 |
| 16 |
| ||
故答案为:4CrO3
| ||
(4)①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强溶液的导电能力;
②溶液中c(OH-)=
| 3 |
| ||
| 3 |
| ||
| 3 | 2.0×10-25 |
| Ksp[Cr(OH)3] |
| c3(OH-) |
| 6.0×10-31 |
| 2.0×10-25 |
故答案为:3.0×10ˉ6.
点评:本题考查了氧化还原反应、Ksp的有关计算,以及图象分析,题目难度中等,注意对图象的分析和数据的处理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Al3+、Na+、Cl-、SO42- |
对已达到化学平衡的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,说法正确的是( )
| A、升高温度,正、逆反应速率都增大,平衡向逆方向移动 |
| B、减少压强,逆反应速率增大,正反应速率减少,平衡向逆方向移动 |
| C、移去部分SO3,正反应速率增大,逆反应速率减少,平衡向正方向移动 |
| D、加入催化剂,正、逆反应速率都增大,平衡常数不变 |
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示: 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.