题目内容
17.按要求用序号填空(1)有以下物质①CO、CO2 ②H2、D2、T2 ③${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl ④14C、14N ⑤液氨、氨水
⑥O2、O3 ⑦CH2=CH2、CH3CH2CH3 ⑧
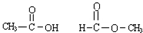
其中属于互为同位素的是③,同素异形体是⑥,同分异构体是⑧.
(2)现有①BaCl2②金刚石 ③NH4Cl ④Na2S ⑤干冰 ⑥碘片 六种物质,熔化时需要破坏共价键的是②,属于离子晶体的是①③④,晶体含有两种化学键的是③,含有分子间作用力的是⑤⑥.
分析 (1)质子数相同中子数不同的同一元素的不同原子互称同位素,同位素必须原子;同一元素形成的不同单质称同素异形体,同素异形体必须是单质;分子式相同结构不同的化合物互称同分异构体;
(2)①BaCl2中只含离子键,②金刚石中只含C-C共价键,③NH4Cl属离子晶体,含离子键、共价键、配位键,④Na2S中含离子键,⑤干冰中只含C=O共价键,⑥碘片中只含I-I非极性键,以此来解答.
解答 解:(1)同位素:质子数相同中子数不同的同一元素的原子互称同位素,则③${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl互为同位素;
同素异形体:同种元素组成的不同单质,则⑥O2、O3 属于同素异形体;
同分异构体:分子式相同结构不同的化合物,则⑧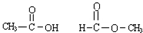 属于同分异构体;
属于同分异构体;
故答案为:③;⑥;⑧;
(2)①BaCl2中只含离子键,②金刚石中只含C-C共价键,③NH4Cl属离子晶体,含离子键、共价键、配位键,④Na2S中含离子键,⑤干冰中只含C=O共价键,⑥碘片中只含I-I非极性键.
熔化时需要破坏共价键的是②,属于离子晶体的是①③④,晶体含有两种化学键的是③,含有分子间作用力的是⑤⑥.
故答案为:②;①③④;③;⑤⑥.
点评 本题考查了几种常见的化学用语和化学键及晶体性质等,为高频考点,把握化学键的形成及化合物中的化学键为解答的关键,侧重分析与应用能力的考查,注意含离子键的化合物一定为离子化合物,题目难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
7.下列实验方法或操作能达到实验目的是( )
| A. |  分离乙醇和水 | B. |  闻氯气的气味 | ||
| C. |  制取乙酸乙酯 | D. |  进行葡萄糖与新制Cu(OH)2的反应 |
8.关于酸、碱、盐的下列各种说法中,正确的是( )
| A. | 化合物电离时,生成的阳离子是氢离子的是酸 | |
| B. | 化合物电离时,生成的阴离子是氢氧根离子的是碱 | |
| C. | 化合物电离时,生成金属阳离子和酸根离子的是盐 | |
| D. | NH4Cl的电离方程式是:NH4Cl═NH4++Cl-,NH4+不是金属阳离子,所以NH4Cl不是盐 |
5.可以将反应E+B2+=E2++B设计成原电池,下列4个电极反应:
①B-2e-=B2+
②E-2e-=E2+
③B2++2e-=B
④E2++2e-=E
其中表示负极反应和正极反应的分别是( )
①B-2e-=B2+
②E-2e-=E2+
③B2++2e-=B
④E2++2e-=E
其中表示负极反应和正极反应的分别是( )
| A. | ②和③ | B. | ②和① | C. | ③和① | D. | ④和① |
2.反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g) 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加Fe(s)的量 | B. | 将容器的体积缩小一半 | ||
| C. | 升高温度 | D. | 通入水蒸气 |
6.相同状况下,等质量的下列烃类燃烧产生的CO2比乙烯低的是( )
| A. | C2H6 | B. | C2H2 | C. | C3H6 | D. | C6H6 |