题目内容
7.下列实验方法或操作能达到实验目的是( )| A. |  分离乙醇和水 | B. |  闻氯气的气味 | ||
| C. |  制取乙酸乙酯 | D. |  进行葡萄糖与新制Cu(OH)2的反应 |
分析 A.乙醇和水互溶;
B.氯气有毒,用手轻轻扇动,使极少量气体进入鼻孔;
C.食盐水不利于除去乙酸;
D.葡萄糖与新制Cu(OH)2加热反应,试管中液体不能超过容积的$\frac{1}{3}$.
解答 解:A.乙醇和水互溶,不能利用分液漏斗分离,故A错误;
B.氯气有毒,用手轻轻扇动,使极少量气体进入鼻孔,操作合理,故B正确;
C.食盐水不利于除去乙酸,应选饱和碳酸钠溶液,故C错误;
D.葡萄糖与新制Cu(OH)2加热反应,试管中液体不能超过容积的$\frac{1}{3}$,图中试管中液体过多,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、性质实验及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列关于反应过程中能量变化的说法正确的是( )
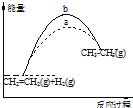

| A. | 图1的曲线说明该反应是放热反应,即CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0 | |
| B. | 化合反应都是放热反应,分解反应都是吸热反应 | |
| C. | 若图1表示有无使用催化剂时的反应进程,则b曲线使用,a曲线没使用 | |
| D. | 图中,若△H=QkJ•mol-1(Q>0),表示正反应活化能比逆反应活化能大QkJ•mol-1 |
2.下列关于Na2CO3和NaHCO3的说法中,正确的是( )
| A. | 相同温度下在水中的溶解度:Na2CO3<NaHCO3 | |
| B. | 相同浓度时pH大小关系为:Na2CO3<NaHCO3 | |
| C. | 等质量的两种固体,分别与过量盐酸反应,生成CO2的质量碳酸氢钠多 | |
| D. | 分别取1mol/L的两种溶液,滴入氯化钙溶液,两个皆有沉淀产生 |
19.下列说法正确的是( )
| A. | 纤维素与淀粉互为同分异构体 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下均能水解 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
16.Na2CO3和NaHCO3是厨房中常见物质,下列叙述不正确的是( )
| A. | Na2CO3和NaHCO3都能与盐酸反应放出CO2气体 | |
| B. | Na2CO3和NaHCO3的水溶液均呈碱性 | |
| C. | NaHCO3比Na2CO3热稳定性强 | |
| D. | Na2CO3和NaHCO3的焰色反应均呈黄色 |

 .
.

