题目内容
9.现有下列十种物质:①AgCl ②铜 ③液态醋酸 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦NaHCO3 ⑧稀硝酸 ⑨熔融NaCl ⑩NaHSO4(1)上述状态下可导电的是②⑧⑨;(填序号,下同)属于强电解质的是①⑤⑥⑦⑨⑩;属于非电解质的是④.
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)⑩与⑦反应的离子方程式为HCO3-+H+=H2O+CO2↑.
分析 (1)物质导电的原因是有自由移动的电子或自由移动的离子;
在水溶液中或者熔化状态下能完全电离的是电解质属于强电解质,只能部分电离的属于弱电解质;
在水溶液中和熔化状态下都不能导电的化合物属于非电解质,包括非金属氧化物、氨气和大多数有机物;
(2)H++OH-═H2O,表示可溶性强酸和可溶性强碱发生酸碱中和反应生成可溶性盐和水;
(3)碳酸氢钠和硫酸氢钠反应的实质是碳酸氢根离子和氢离子之间的反应.
解答 解:(1)①AgCl中离子不能自由移动,故不能导电;在熔融状态下能完全电离,故为强电解质; ②铜能导电;但铜是单质,故既不是电解质也不是非电解质; ③液态醋酸中无自由移动的离子,故不能导电;但在水溶液中能部分电离,故为弱电解质; ④CO2无自由移动的离子,故不能导电;在水溶液中导电和其本身无关,在熔融状态下不能导电,故为非电解质; ⑤H2SO4中无自由移动的离子,故不能导电;但在水溶液中能完全电离,故为强电解质;⑥Ba(OH)2固体中无自由移动的离子,故不能导电;但在水溶液中和熔融状态下能完全电离,故为强电解质;⑦NaHCO3中无自由移动的离子,故不能导电;但在水溶液中能完全电离,故为强电解质;⑧稀硝酸有自由移动的离子,故能导电;但由于是混合物,故既不是电解质也不是非电解质;⑨熔融NaCl中有自由移动的离子,故能导电;在水溶液中和熔融状态下能完全电离,故为强电解质;⑩NaHSO4中离子不能自由移动,故不能导电;但在水溶液中和熔融状态下能完全电离,故为强电解质.
故能导电的为②⑧⑨;是强电解质的是①⑤⑥⑦⑨;是非电解质的是④;故答案为:②⑧⑨;①⑤⑥⑦⑨⑩;④;
(2)离子方程式H++OH-═H2O表示可溶性强酸和可溶性强碱发生酸碱中和反应生成可溶性盐和水,故Ba(OH)2和HNO3的反应符合,化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O,故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(3)碳酸氢钠和硫酸氢钠反应的实质是碳酸氢根离子和氢离子之间的反应,即HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑.
点评 本题考查电解质、非电解质的概念和强弱电解质的区分以及物质导电的原因,题目难度中等,注意离子方程式的书写,为该题的主要考查对象,学习中注意把握.

 阅读快车系列答案
阅读快车系列答案| A. | 纤维素与淀粉互为同分异构体 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下均能水解 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
| A. | Cl2是氧化剂,H2O是还原剂 | B. | H2O是氧化剂,Cl2是还原剂 | ||
| C. | Cl2既是氧化剂,又是还原剂 | D. | H2O既不是氧化剂,又不是还原剂 |
| A. | Al3+、K+、NO3-、Cl- | B. | K+、Na+、HS-、Cl- | ||
| C. | Na+、AlO2-、SO42-、NO3- | D. | Ba2+、Na+、Cl-、NO3- |
| A. | 64种 | B. | 16种 | C. | 8种 | D. | 32种 |
| A. | CH4的稳定性高于SiH4,可推测CH4的沸点也高于SiH4 | |
| B. | 氯化钠的晶格能比氯化铯的晶格能小 | |
| C. | 根据价电子构型与化合价的关系,推出最外层电子数3个的元素一定是第ⅢA族元素 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出SO2通入NaClO溶液中能生成HClO |
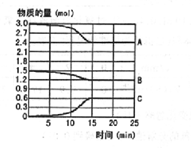 在600℃时,将一定量的SO2和O2充入一个容积固定为2L的密闭容器中,反应过程中各种物质的量随时间的变化如图所示.
在600℃时,将一定量的SO2和O2充入一个容积固定为2L的密闭容器中,反应过程中各种物质的量随时间的变化如图所示.