题目内容
18.把1mol X和1mol Y混合于2L的密闭容器中,发生如下反应 2X(g)+Y(g)=nZ(g)+2W(g),2min末X的物质的量为0.2mol,以Z的浓度表示的反应速率为0.1mol/(L•min)请回答:
(1)前2min以X的浓度表示的平均反应速率
(2)n值.
分析 (1)根据v=$\frac{\frac{△n}{V}}{△t}$计算前2min以X的浓度表示的平均反应速率;
(2)根据速率之比等于化学计量数之比计算n.
解答 解:(1)2min末X的物质的量为0.2mol,则v(X)=$\frac{\frac{1mol-0.2mol}{2L}}{2min}$=0.2mol/(L•min)
答:前2min以X的浓度表示的平均反应速率为0.2mol/(L•min);
(2)速率之比等于其化学计量数之比,则n:2=0.1mol/(L•min):0.2mol/(L•min),故n=1,
答:n的值为1.
点评 本题考查化学反应速率有关计算,常利用定义式或速率规律进行计算,根据情况选择合适的计算方法,注意对速率定义式的理解与灵活运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化引发高氯酸铵反应,其方程式可表示为:NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑;△H<0 下列对此反应的叙述中错误的是( )
| A. | 上述反应属于分解反应 | |
| B. | 上述反应瞬间产生大量高温气体推动航天飞机飞行 | |
| C. | 反应从能量变化上说,主要是化学能转变为热能和动能 | |
| D. | 在反应中高氯酸铵只能起氧化剂作用 |
13.对于A2+3B2=2C+2D反应,以下化学反应速率的表示中,速率最快的是( )
| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(D)=0.7 mol/(L•s) |
3.对于在一定条件下进行的化学反应:2SO2+O2?2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是( )
| A. | 升高温度 | B. | 增大压强 | C. | 减小反应物浓度 | D. | 增大反应物浓度 |
10.下列结论合理的是( )
| A. | CH4的稳定性高于SiH4,可推测CH4的沸点也高于SiH4 | |
| B. | 氯化钠的晶格能比氯化铯的晶格能小 | |
| C. | 根据价电子构型与化合价的关系,推出最外层电子数3个的元素一定是第ⅢA族元素 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出SO2通入NaClO溶液中能生成HClO |
7.下列说法正确的是( )
| A. | CO2、H2O都是非极性分子 | |
| B. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| C. | 用价层电子对互斥理论预测H2S和BF3的立体结构,分别为V形、三角锥形 | |
| D. | 石英、食盐、金属钠、干冰的熔点依次降低 |
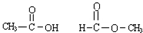
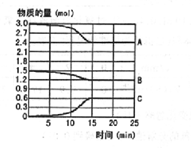 在600℃时,将一定量的SO2和O2充入一个容积固定为2L的密闭容器中,反应过程中各种物质的量随时间的变化如图所示.
在600℃时,将一定量的SO2和O2充入一个容积固定为2L的密闭容器中,反应过程中各种物质的量随时间的变化如图所示.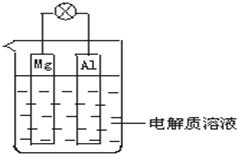 如图所示,试回答下列问题 (灯泡功率合适):
如图所示,试回答下列问题 (灯泡功率合适):