题目内容
16.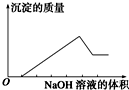 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )| A. | ①②⑤ | B. | ①③④ | C. | ②⑥⑦ | D. | ①②④⑥ |
分析 无色溶液中一定不含③Fe2+,由图可知,先发生酸碱中和反应,则一定含④H+,与④H+反应的⑤⑦一定不存在,结合图象可知生成沉淀后部分溶解,则一定含①②,以此来解答.
解答 解:无色溶液中一定不含③Fe2+,由图可知,先发生酸碱中和反应,则一定含④H+,与④H+反应的⑤⑦一定不存在,结合图象可知生成沉淀后部分溶解,沉淀为氢氧化镁、氢氧化铝,则一定含①②,溶液为电中性,一定含银离子为氯离子,综上所述,一定含离子为①②④⑥,
故选D.
点评 本题考查离子的推断,为高频考点,把握离子之间的反应、图象中离子反应为解答的关键,侧重分析与推断能力的考查,注意电荷守恒应用,题目难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
2.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI/L浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 40g金刚砂(SiC)中含有C-Si键的个数为2NA |
7. 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是2Ag++SO32-=Ag2SO3↓.
②推测a中白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是检验X是否为Ag2O.
②根据上述现象,分析X的性质和元素组成是有还原性; 含有Ag元素,不含S元素.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是2Ag++SO32-=Ag2SO3↓.
②推测a中白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是检验X是否为Ag2O.
②根据上述现象,分析X的性质和元素组成是有还原性; 含有Ag元素,不含S元素.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
11.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,下列叙述正确的是( )
| A. | 是指常温常压下,2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ | |
| B. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ | |
| C. | 是指标准状况下,2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ | |
| D. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
8.下列说法中正确的是( )
| A. | 可用浓硫酸干燥H2、NH3、Cl2等气体 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 氨水、铵盐受热都易发生化学变化 |

 、C
、C .反应④所用试剂和条件是氢氧化钠醇溶液、加热.
.反应④所用试剂和条件是氢氧化钠醇溶液、加热. .
.