题目内容
1.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH${\;}_{4}^{+}$、Cl-、Mg2+、Ba2+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$,为了确定溶液中所含离子及其物质的量浓度,某同学设计实验如下:取三份100mL上述水溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生.
②第二份加入足量NaOH溶液,加热,收集到气体896mL(标准状况).
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,请回答:
(1)溶液中肯定存在的离子是NH4+、SO42-、CO32-、K+;哪些离子的浓度能确定,分别是NH4+、0.4mol/L,SO42-、0.1mol/L,CO32-、0.2mol/L.
(2)肯定不存在的离子是Mg2+、Ba2+.
(3)可能存在的离子是Cl-,如何确定?先加过量Ba(NO3)2溶液,取上层清液,加酸化的AgNO3溶液,若有白色沉淀说明有Cl-,否则无Cl-.
分析 ①第一份加入AgNO3溶液有沉淀产生,说明可能含有Cl-、CO32-、SO42-;
②第二份加足量NaOH溶液加热后,收集到气体0.448L(标准状态下),证明一定含有NH4+;生成的气体为氨气物质的量=$\frac{0.896L}{22.4L/mol}$=0.04mol;无沉淀生成,则溶液中一定不含Mg2+、Cu2+;
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.证明原溶液中一定含有CO32-、SO42-,存在CO32-、SO42-,一定不存在Ba2+;
生成沉淀BaSO4物质的量=$\frac{2.33g}{233g/mol}$═0.01mol;生成的沉淀BaCO3物质的量=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol;根据电荷守恒,存在K+,Cl-不能确定,据此进行解答.
解答 解:第一份:第一份加入AgNO3,溶液有沉淀产生,说明溶液中可能存在:Cl-、CO32-、SO42-;
第二份:加足量NaOH溶液加热后生成标准状况下0.896L气体为氨气,则溶液中一定含有NH4+,且物质的量为:=$\frac{0.896L}{22.4L/mol}$=0.04mol;
第三份:根据题中信息可知2.33为硫酸钡,n(BaSO4)=n(SO42-)=$\frac{2.33g}{233g/mol}$═0.01mol;生成的沉淀BaCO3物质的量=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol;因为一定含CO32-所以不含Mg2+;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;n(-)=2n(CO32-)+2n(SO42-)=0.06mol,故一定有K+,至少0.02mol;
(1)根据分析可知肯定存在的离子是NH4+、SO42-、CO32-、K+;能够确定浓度的离子为NH4+、SO42-、CO32-,
NH4+的物质的量是0.04mol,溶液体积是0.1L,所以c(NH4+)=$\frac{0.04mol}{0.1L}$=0.4mol/L;SO42-物质的量是0.01mol,则c(SO42-)=$\frac{0.01mol}{0.1L}$=0.1mol/L;CO32-的物质的量是0.02mol,则c(CO32-)=$\frac{0.02mol}{0.1L}$=0.2mol/L,
故答案为:NH4+、SO42-、CO32-、K+;NH4+、0.4mol/L,SO42-、0.1mol/L,CO32-、0.2mol/L;
(2)由于Mg2+、Ba2+与CO32-,Ba2+与SO42-发生反应生成沉淀,则溶液中一定不存在Mg2+、Ba2+,
故答案为:Mg2+、Ba2+;
(3)根据分析可知,无法确定是否含有氯离子,可先加过量Ba(NO3)2溶液,除去硫酸根离子,然后取上层清液,加酸化的AgNO3溶液,若有白色沉淀说明有Cl-,否则无Cl-,
故答案为:Cl-;先加过量Ba(NO3)2溶液,取上层清液,加酸化的AgNO3溶液,若有白色沉淀说明有Cl-,否则无Cl-.
点评 本题考查了常见离子的检验方法,题目难度中等,试题涉及到根据电荷守恒推断离子的存在,为易错点,注意熟练掌握常见离子的性质及检验方法,试题培养了学生的分析能力及逻辑推理能力.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案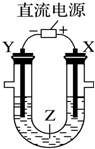
| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的铜离子浓度不变 | |
| C. | 在铁片上镀铜时,Y是纯铜 | |
| D. | 电解水制氢气时,Z可以是稀硫酸溶液 |
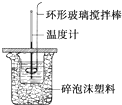 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.55mol•L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C(填序号).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
实验数据如表:
①填写表中的空白:
| 温度 实验次数 | 超始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | / |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③中和热测定实验中,下列操作一定会降低实验准确性的是B.
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度.
| A. | 物质的性质与用途: 磺胺类药物能抑制细菌合成核酸--治疗肺炎、脑膜炎、尿路感染、呼吸道感染 酸能与碱中和-----胃酸过多的病人服用含氢氧化钠的药物 | |
| B. | 保护环境: 控制“白色污染”--减少和控制使用所有塑料制品 防止水的污染--提倡使用无磷洗衣粉 | |
| C. | 基本安全常识: 饮用假酒中毒--由甲醇引起 食用假盐中毒--由亚硝酸钠引起 | |
| D. | 生活中的一些做法: 除去衣服上的油污--可用汽油洗涤 使煤燃烧更旺--可增大煤与空气接触面积 |
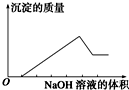 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )| A. | ①②⑤ | B. | ①③④ | C. | ②⑥⑦ | D. | ①②④⑥ |
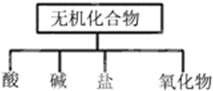
(1)如图所示的物质分类方法名称是树状分类法.
(2)以Na、K、H、O、C、S、N中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面.
| 物质 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②HNO3 | ③NaOH、KOH或NH3•H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥NaNO3、Na2SO4或NH4NO3 | ⑦CO2 ⑧Na2O |
(4)实验室制备⑦检验该气体的方法是将气体通入澄清的石灰水中,变浑浊,则说明该气体是二氧化碳.
| A. | 第17.18列元素都是非金属元素 | |
| B. | 第14列元素形成的化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
| A. | 空气中的SO2溶于水,最终形成酸雨 | |
| B. | 汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物 | |
| C. | 工业废水任意排放是造成酸雨的主要原因 | |
| D. | 为了减少酸雨的形成,必须减少SO2的排放量,对燃料脱硫处理 |