题目内容
8.下列说法中正确的是( )| A. | 可用浓硫酸干燥H2、NH3、Cl2等气体 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 氨水、铵盐受热都易发生化学变化 |
分析 A.浓硫酸能与氨气反应;
B.氯化钡中含有氯离子,溶液中含银离子、硫酸根离子可以生成白色沉淀;
C.不能在量筒中稀释浓硫酸;
D.一水合氨受热分解生成氨气、铵盐受热易分解.
解答 解:A.浓硫酸具有吸水性,可以作干燥剂,浓硫酸能与氨气反应,不能干燥氨气,故A错误;
B.氯化钡中含有氯离子,溶液中含银离子、硫酸根离子可以生成白色沉淀,所以产生白色沉淀不一定含有SO42-,故B错误;
C.不能在量筒中稀释浓硫酸,应该把浓硫酸倒入含有水的烧杯中,故C错误;
D.一水合氨受热分解生成氨气,铵盐受热易分解,所以氨水、铵盐受热都易发生化学变化,故D正确.
故选D.
点评 本题考查了物质的性质和用途,题目难度不大,注意把握浓硫酸的性质以及用作干燥剂时不能干燥还原性和碱性气体.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.向紫色石蕊试液中加入过量的过氧化钠粉末,振荡,正确的叙述是( )
| A. | 溶液为紫色 | B. | 最后溶液变为蓝色 | ||
| C. | 最后溶液褪色 | D. | 有气泡产生 |
16.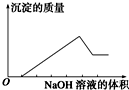 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )| A. | ①②⑤ | B. | ①③④ | C. | ②⑥⑦ | D. | ①②④⑥ |
3.化学在生产生活和科学研究中具有重要的作用.下列说法正确的是( )
①硅石的主要成分是二氧化硅
②三峡大坝使用了大量水泥,水泥是硅酸盐材料
③嫦娥二号卫星上所用的太阳能电池采用硅材料制作,太阳能电池在生活中的应用有利于环保、节能
④二氧化硅的熔点高,硬度大,可用来制造电子部件和光学器件
⑤水晶项链和餐桌上的瓷盘都是硅酸盐制品.
①硅石的主要成分是二氧化硅
②三峡大坝使用了大量水泥,水泥是硅酸盐材料
③嫦娥二号卫星上所用的太阳能电池采用硅材料制作,太阳能电池在生活中的应用有利于环保、节能
④二氧化硅的熔点高,硬度大,可用来制造电子部件和光学器件
⑤水晶项链和餐桌上的瓷盘都是硅酸盐制品.
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②③④ |
17.结晶氯化铝(AlCl3•6H20)在精密铸造中可以代替氯化铵,也是生产净水剂聚合氯化铝的中间产品.以煤矸石(含有Al203、Fe203及Si02等)为原料制备结晶氯化铝是煤矸石资源利用的重要方式之一,工艺流程如下.请回答:
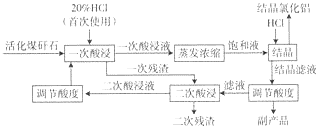
(1)结晶滤液的主要成分是AlCl3、FeCl3和HCl,二次残渣的主要成分是SiO2(填化学式).
(2)该工艺流程中可以循环使用的物质是盐酸,循环利用该物质的优点是充分利用原料降低成本,缺点是杂质的富集可能会影响后续AlCl3•6H2O产品的纯度.
(3)为了分析二次残渣中铁元素的含量,某同学称取5.000g二次残渣,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液,然后移取25.00mL用1.000×l0-2mol•L-lKMn04标准溶液滴定,消耗标准溶液20.00mL.已知反应式为:Fe2++Mn04-+H+→Fe3++Mn2++H20(未配平),二次残渣中铁元素的质量分数为4.480%.
(4)下表为HCl通入体积对AlCl3结晶效率和HC1利用率的影响.
结晶效率变化的原因是氯化铝的溶解度会随着溶液中盐酸浓度的增加而下降;随HC1体积的增大,HC1利用率降低的原因可能是通入的HCl气体使溶液中的盐酸浓度升高,继续通入HCl气体,降低了气体在溶液中的吸收效率.
(5)将结晶氯化铝加入一定量蒸馏水,在lOO℃水浴中加热蒸干即可得到聚合氯化铝[Al2(OH)nCl6-n•H20]m.由结晶氯化铝制取Al2(OH)nCl6-n的化学方程式为2AlCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al2(OH)nCl6-n+nHCl+(12-n)H2O.

(1)结晶滤液的主要成分是AlCl3、FeCl3和HCl,二次残渣的主要成分是SiO2(填化学式).
(2)该工艺流程中可以循环使用的物质是盐酸,循环利用该物质的优点是充分利用原料降低成本,缺点是杂质的富集可能会影响后续AlCl3•6H2O产品的纯度.
(3)为了分析二次残渣中铁元素的含量,某同学称取5.000g二次残渣,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液,然后移取25.00mL用1.000×l0-2mol•L-lKMn04标准溶液滴定,消耗标准溶液20.00mL.已知反应式为:Fe2++Mn04-+H+→Fe3++Mn2++H20(未配平),二次残渣中铁元素的质量分数为4.480%.
(4)下表为HCl通入体积对AlCl3结晶效率和HC1利用率的影响.
| HCl气体体积/(m3.L-1) | 结晶效率/% | HCl利用效率/% |
| 0.0375 | 11.8 | 93.2 |
| 0.075 | 31.5 | 89.8 |
| 0.1225 | 59.0 | 83.2 |
| 0.15 | 68.0 | 74.9 |
| 0.1875 | 71.0 | 67.8 |
| 0.225 | 73.1 | 59.1 |
(5)将结晶氯化铝加入一定量蒸馏水,在lOO℃水浴中加热蒸干即可得到聚合氯化铝[Al2(OH)nCl6-n•H20]m.由结晶氯化铝制取Al2(OH)nCl6-n的化学方程式为2AlCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al2(OH)nCl6-n+nHCl+(12-n)H2O.
18.科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是( )
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | 在一定条件下,CO2原子晶体转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和CO2分子晶体具有相同的物理性质 | |
| D. | 在CO2的原子晶体中,每个碳原子周围结合四个氧原子,每个氧原子周围结合两个碳原子 |
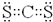 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).