题目内容
11.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,下列叙述正确的是( )| A. | 是指常温常压下,2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ | |
| B. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ | |
| C. | 是指标准状况下,2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ | |
| D. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
分析 根据2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol表示2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ,即可解答.
解答 解:该化学方程式指的是在标准状况下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出的热量是571.6 kJ,也即在标准状况下,2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ,故选B.
点评 本题考查热化学方程式的意义,题目难度不大,注意热化学方程式的意义理解.

练习册系列答案
相关题目
19.向紫色石蕊试液中加入过量的过氧化钠粉末,振荡,正确的叙述是( )
| A. | 溶液为紫色 | B. | 最后溶液变为蓝色 | ||
| C. | 最后溶液褪色 | D. | 有气泡产生 |
6.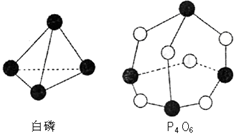 化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
 化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )| A. | -1638kJ/mol | B. | +1638kJ/mol | C. | -126kJ/mol | D. | +126kJ/mol |
16.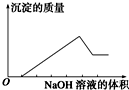 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )| A. | ①②⑤ | B. | ①③④ | C. | ②⑥⑦ | D. | ①②④⑥ |
3.化学在生产生活和科学研究中具有重要的作用.下列说法正确的是( )
①硅石的主要成分是二氧化硅
②三峡大坝使用了大量水泥,水泥是硅酸盐材料
③嫦娥二号卫星上所用的太阳能电池采用硅材料制作,太阳能电池在生活中的应用有利于环保、节能
④二氧化硅的熔点高,硬度大,可用来制造电子部件和光学器件
⑤水晶项链和餐桌上的瓷盘都是硅酸盐制品.
①硅石的主要成分是二氧化硅
②三峡大坝使用了大量水泥,水泥是硅酸盐材料
③嫦娥二号卫星上所用的太阳能电池采用硅材料制作,太阳能电池在生活中的应用有利于环保、节能
④二氧化硅的熔点高,硬度大,可用来制造电子部件和光学器件
⑤水晶项链和餐桌上的瓷盘都是硅酸盐制品.
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②③④ |
1.某化学研究性学习小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题
【实验目的】测定食醋的总酸量
【实验原理】中和滴定
【实验用品】蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g/100mL),0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊).
【实验步骤】
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中.
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置,读取数据并记录为NaOH标准溶液体积的初读数.
③滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点.记录NaOH的终读数.重复滴定3次.
【数据记录】
【问题与思考】
(1)步骤①中中还需补充的仪器有洗耳球、玻璃棒、胶头滴管.蒸馏水的处理方法是蒸馏水煮沸除去CO2并迅速冷.
(2)步骤③中你选择的酸碱指示剂是酚酞,理由是滴定产物CH3COONa溶液呈碱性,应选择在碱性范围中变色的指示剂.
(3)若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是用活性炭脱色.
(4)样品总酸量=4.50g/100mL.
【实验目的】测定食醋的总酸量
【实验原理】中和滴定
【实验用品】蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g/100mL),0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊).
【实验步骤】
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中.
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置,读取数据并记录为NaOH标准溶液体积的初读数.
③滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点.记录NaOH的终读数.重复滴定3次.
【数据记录】
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
(1)步骤①中中还需补充的仪器有洗耳球、玻璃棒、胶头滴管.蒸馏水的处理方法是蒸馏水煮沸除去CO2并迅速冷.
(2)步骤③中你选择的酸碱指示剂是酚酞,理由是滴定产物CH3COONa溶液呈碱性,应选择在碱性范围中变色的指示剂.
(3)若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是用活性炭脱色.
(4)样品总酸量=4.50g/100mL.
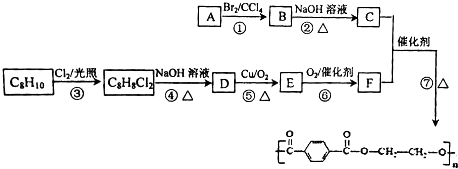
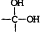 →
→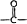 +H2O
+H2O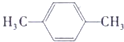 .
.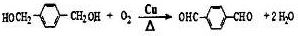 ;
;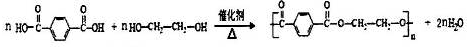 .
.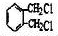 .
.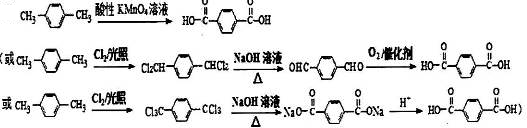 (有机物用结构简式表示,无机试剂任选).
(有机物用结构简式表示,无机试剂任选).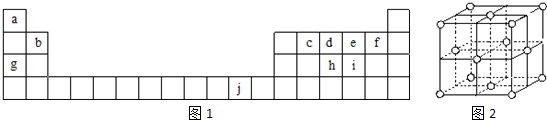
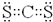 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).