题目内容
4.在实验室测定碳酸钠与碳酸氢钠的混合物中碳酸钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.lg,溶于水中,配成250mL溶液.a.方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w (Na2CO3).
(1)量取100mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是D (填编号).
A.CaCl2 B.MgSO4 C..NaCI D.Ba(OH)2
(2)简述证明HCO3-、CO32-已完全沉淀的实验操作静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3-、CO32-已沉淀完全,反之,未沉淀完全.
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器有烧杯、玻璃棒、普通漏斗.
(4)洗涤沉淀,简述洗涤沉淀的操作向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次.
(5)干燥充分,称取沉淀的质量为9.8g,由此计算w(Na2CO3).如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)偏小(填偏大或偏小、无影响).
b.方案二:滴定法测w(Na2CO3)量取25.00mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000mol/L的盐酸进行滴定到终点.重复此操作2次,消耗盐酸的体积平均值为20.00mL.[已知饱和的碳酸溶液PH为3.9]
(1)量取25.00mL配制好的溶液,应选择碱式滴定管仪器来完成.
(2)判断滴定终点的依据是由红色突变为无色且30s不恢复,此过程中反应的离子方程式为H++CO32-=HCO3-.
(3)此法测得w(Na2CO3)=83.14%(保留两位小数)
分析 a方案一:(1)滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,关键是该沉淀剂能够与碳酸氢根离子反应生成沉淀;
(2)可以直接向原溶液中加入氢氧化钡溶液,根据反应现象判断HCO3-、CO32-是否沉淀完全;
(3)根据过滤操作的方法判断需要使用的仪器名称;
(4)洗涤沉淀的操作为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次;
(5)沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,据此判断对测定结果的影响;
b方案二:(1)碳酸钠、碳酸氢钠的混合液显碱性,应该用碱式滴定管量取;
(2)酚酞的变色范围是8.2~10.0,反应结束时溶液由红色突变为无色,据此判断滴定终点;反应方程式为:H++CO32-=HCO3-;
(3)根据反应H++CO32-=HCO3-计算出50 mL样品溶液中含有的碳酸钠的物质的量,然后计算出250mL样品溶液中含有的碳酸钠的物质的量,再根据m=nM计算出碳酸钠的质量,最后根据质量分数的表达式计算出样品中碳酸钠的质量分数.
解答 解:a方案一:(1)A.CaCl2溶液只能与碳酸根反应转化为碳酸根沉淀,故A错误;
B.MgSO4溶液与HCO3-、CO32-均不反应,故B错误;
C.NaCl溶液与HCO3-、CO32-都不反应,故C错误;
D.Ba(OH)2溶液与HCO3-、CO32-都发生反应生成碳酸钡沉淀,故D正确;
故答案为:D;
(2)要证明HCO3-、CO32-已完全沉淀,则可以继续滴加氢氧化钡溶液,即正确的实验操作方法为:静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3-、CO32-已沉淀完全,反之,未沉淀完全,
故答案为:静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3-、CO32-已沉淀完全,反之,未沉淀完全;
(3)过滤操作所需要的玻璃仪器有:烧杯、玻璃棒、普通漏斗,
故答案为:烧杯、玻璃棒、普通漏斗;
(4)洗涤沉淀的操作为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次,
故答案为:向漏斗中的沉淀中加入蒸馏水,直到淹没沉淀,静置让水自行留下,重复2-3次;
(5)如果此步中,沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,所以如果称量值偏大,则碳酸氢钠的质量偏大,则碳酸钠的含量偏小,故答案为:偏小;
b方案二:(1)溶液显碱性,因此应该用碱式滴定管量取,故答案为:碱式滴定管;
(2)酚酞的变色范围是8.2~10.0,所以判断滴定终点的依据是由红色突变为无色,且30s不恢复,发生的离子方程式为:H++CO32-=HCO3-,
故答案为:由红色突变为无色,且30s不恢复;H++CO32-=HCO3-;
(3)反应达到终点时,发生的离子方程式为:H++CO32-=HCO3-,
则根据消耗盐酸的体积可知20.00ml可知,消耗碳酸钠的物质的量为:0.2000 mol/L×0.02000L=0.004mol,
则原混合物中碳酸钠的物质的量为:0.004mol×$\frac{250ml}{25ml}$=0.04mol,质量为:0.04mol×106g/mol=4.24g,
所以碳酸钠质量分数为:$\frac{4.24g}{5.1g}$×100%=83.14%,
故答案为:83.14.
点评 本题考查碳酸钠和碳酸氢钠混合物中碳酸钠含量测定的实验方案设计与评价,题目难度中等,明确化学实验基本操作方法及碳酸钠、碳酸氢钠的性质为解答此题关键,试题充分考查了学生的分析、理解能力及化学实验、化学计算能力.

| A. | NaOH+HCl═NaCl+H2O | B. | CuO+H2SO4═CuSO4+H2O | ||
| C. | Zn+2H+═Zn2++H2↑ | D. | CaO+H2O═Ca(OH)2 |
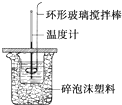 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.55mol•L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C(填序号).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
实验数据如表:
①填写表中的空白:
| 温度 实验次数 | 超始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | / |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③中和热测定实验中,下列操作一定会降低实验准确性的是B.
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度.
| A. | 溶液为紫色 | B. | 最后溶液变为蓝色 | ||
| C. | 最后溶液褪色 | D. | 有气泡产生 |
| A. | 物质的性质与用途: 磺胺类药物能抑制细菌合成核酸--治疗肺炎、脑膜炎、尿路感染、呼吸道感染 酸能与碱中和-----胃酸过多的病人服用含氢氧化钠的药物 | |
| B. | 保护环境: 控制“白色污染”--减少和控制使用所有塑料制品 防止水的污染--提倡使用无磷洗衣粉 | |
| C. | 基本安全常识: 饮用假酒中毒--由甲醇引起 食用假盐中毒--由亚硝酸钠引起 | |
| D. | 生活中的一些做法: 除去衣服上的油污--可用汽油洗涤 使煤燃烧更旺--可增大煤与空气接触面积 |
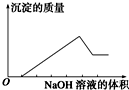 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )