题目内容
7. 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是2Ag++SO32-=Ag2SO3↓.
②推测a中白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是检验X是否为Ag2O.
②根据上述现象,分析X的性质和元素组成是有还原性; 含有Ag元素,不含S元素.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
分析 (1)Na2SO3为强碱弱酸盐,在溶液中水解显碱性,AgNO3为强酸弱碱盐,在溶液中水解显酸性;
(2)①推测a中白色沉淀为Ag2SO3,Ag+与SO32-反应生成Ag2SO3,Ag2SO3溶于过量的Na2SO3溶液;
②推测a中白色沉淀为Ag2SO4,SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀;
(3)设计实验确认白色沉淀是否为Ag2SO4,根据Ag2SO3白色,难溶于水,溶于过量Na2SO3的溶液分析,设计对照试验;
(4)①亚硫酸银能分解生成氧化银,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,因氧化银和盐酸生成白色氯化银沉淀和水;
②向X中加入过量浓HNO3,产生红棕色气体为NO2,说明为银和硝酸的反应,分析X是银;
③银和硝酸反应生成硝酸银、二氧化氮、水;
(5)①溶液的酸性增强,+4价硫的还原性增强,能被+1价银氧化,+4价硫的氧化物为二氧化硫;
②酸性增强,+4价硫的亚硫酸银,被+1价银氧化生成银和硫酸.
解答 解:(1)Na2SO3为强碱弱酸盐,在溶液中水解显碱性,则溶液的pH=10,其水解离子方程为:SO32-+H2O?HSO3-+OH-,AgNO3为强酸弱碱盐,在溶液中pH=5,其水解离子方程为:Ag++H2O?H++AgOH,
故答案为:SO32-、Ag+;
(2)①推测a中白色沉淀为Ag2SO3,Ag+与SO32-反应生成Ag2SO3,Ag2SO3溶于过量的Na2SO3溶液,生成沉淀的离子方程式为:2Ag++SO32-=Ag2SO3↓,
故答案为:2Ag++SO32-=Ag2SO3↓;
②推测a中白色沉淀为Ag2SO4,其依据为:SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀,
故答案为:SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀;
(3)Ag2SO3白色,难溶于水,溶于过量Na2SO3的溶液,取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解,说明B、C中白色沉淀为Ag2SO3,另取Ag2SO4固体,同样条件置于足量Na2SO3溶液中,进行对照试验,发现沉淀不溶解,
故答案为:Na2SO3;
(4)①氧化银能和盐酸生成白色氯化银沉淀和水,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,
故答案为:检验X是否为Ag2O;
②向X中加入过量浓HNO3,产生红棕色气体为NO2,X与浓硝酸发生氧化还原反应,X具有还原性,X只能为金属单质,只能为银,含有Ag元素,不含S元素,
故答案为:有还原性; 含有Ag元素,不含S元素;
③向X中加入过量浓HNO3,产生红棕色气体为NO2,银和硝酸反应,氮元素从+5变为+4价,同时生成硝酸银和水,反应方程式为:Ag+2HNO3(浓)═AgNO3+NO2↑+H2O,
故答案为:Ag+2HNO3(浓)═AgNO3+NO2↑+H2O;
(5)①海绵状棕黑色物质X为Ag,产生Ag的原因,可能为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化,实验确认,可通+4价硫的氧化物二氧化硫进行实验确认,通入二氧化硫后,瓶中白色沉淀Ag2SO3转化为棕黑色Ag,
故答案为:SO2;
②X为Ag,白色沉淀转化为X,为在酸性条件下,亚硫酸银中+4价的硫,被+1价银氧化生成银和硫酸,反应为:Ag2SO3+H2O=2Ag+H2SO4,
故答案为:Ag2SO3+H2O=2Ag+H2SO4.
点评 本题考查物质组成的探究实验,侧重于学生的分析能力的考查,熟练掌握元素化合物及氧化还原反应知识,题目难度中等.

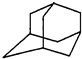 如图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂.下列有关说法中正确的是( )
如图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂.下列有关说法中正确的是( )| A. | 金刚烷的分子中有18个碳原子 | |
| B. | 1-溴金刚烷的结构有2种 | |
| C. | 金刚烷属于烷烃的同系物 | |
| D. | 金刚烷应该具有和芳香烃相似的化学性质 |
| A. | NaOH+HCl═NaCl+H2O | B. | CuO+H2SO4═CuSO4+H2O | ||
| C. | Zn+2H+═Zn2++H2↑ | D. | CaO+H2O═Ca(OH)2 |
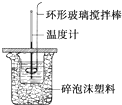 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.55mol•L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C(填序号).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
实验数据如表:
①填写表中的空白:
| 温度 实验次数 | 超始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | / |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③中和热测定实验中,下列操作一定会降低实验准确性的是B.
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度.
| A. | 溶液为紫色 | B. | 最后溶液变为蓝色 | ||
| C. | 最后溶液褪色 | D. | 有气泡产生 |
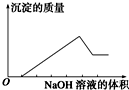 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )| A. | ①②⑤ | B. | ①③④ | C. | ②⑥⑦ | D. | ①②④⑥ |
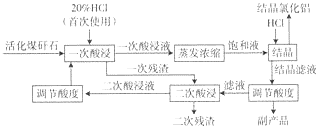
(1)结晶滤液的主要成分是AlCl3、FeCl3和HCl,二次残渣的主要成分是SiO2(填化学式).
(2)该工艺流程中可以循环使用的物质是盐酸,循环利用该物质的优点是充分利用原料降低成本,缺点是杂质的富集可能会影响后续AlCl3•6H2O产品的纯度.
(3)为了分析二次残渣中铁元素的含量,某同学称取5.000g二次残渣,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液,然后移取25.00mL用1.000×l0-2mol•L-lKMn04标准溶液滴定,消耗标准溶液20.00mL.已知反应式为:Fe2++Mn04-+H+→Fe3++Mn2++H20(未配平),二次残渣中铁元素的质量分数为4.480%.
(4)下表为HCl通入体积对AlCl3结晶效率和HC1利用率的影响.
| HCl气体体积/(m3.L-1) | 结晶效率/% | HCl利用效率/% |
| 0.0375 | 11.8 | 93.2 |
| 0.075 | 31.5 | 89.8 |
| 0.1225 | 59.0 | 83.2 |
| 0.15 | 68.0 | 74.9 |
| 0.1875 | 71.0 | 67.8 |
| 0.225 | 73.1 | 59.1 |
(5)将结晶氯化铝加入一定量蒸馏水,在lOO℃水浴中加热蒸干即可得到聚合氯化铝[Al2(OH)nCl6-n•H20]m.由结晶氯化铝制取Al2(OH)nCl6-n的化学方程式为2AlCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al2(OH)nCl6-n+nHCl+(12-n)H2O.