题目内容
下列电极反应式正确的是( )
| A、氯碱工业电解饱和食盐水时,阳极电极反应式为 2Cl--2e-=Cl2↑ |
| B、精炼铜时,与电源正极相连的是纯铜,电极反应式为 Cu-2e-=Cu2+ |
| C、氢氧燃料电池的负极反应式 O2+2H2O+4e-=4OH- |
| D、钢铁发生电化腐蚀的正极反应式 Fe-2e-=Fe2+ |
考点:电极反应和电池反应方程式
专题:电化学专题
分析:A、在电解池的阳极上是阴离子(或是金属电极本身)失电子发生氧化反应的过程;
B、精炼铜时,与电源负极相连的是纯铜,正极相连的是粗铜;
C、氢氧燃料电池的负极上是燃料失电子的氧化反应过程;
D、钢铁发生电化腐蚀时,在负极上是金属失电子的过程.
B、精炼铜时,与电源负极相连的是纯铜,正极相连的是粗铜;
C、氢氧燃料电池的负极上是燃料失电子的氧化反应过程;
D、钢铁发生电化腐蚀时,在负极上是金属失电子的过程.
解答:
解:A、氯碱工业电解饱和食盐水时,在电解池的阳极上是阴离子氯离子失电子发生氧化反应的过程,即2Cl--2e-=Cl2↑,故A正确;
B、精炼铜时,与电源负极相连的是纯铜,电极反应式为 Cu-2e-=Cu2+,故B错误;
C、氢氧燃料电池的负极上是燃料失电子的氧化反应过程,正极上是氧气得电子的还原反应,故C错误;
D、钢铁发生电化腐蚀时,在负极上是金属铁失电子的过程,即Fe-2e-=Fe2+,故D错误.
故选A.
B、精炼铜时,与电源负极相连的是纯铜,电极反应式为 Cu-2e-=Cu2+,故B错误;
C、氢氧燃料电池的负极上是燃料失电子的氧化反应过程,正极上是氧气得电子的还原反应,故C错误;
D、钢铁发生电化腐蚀时,在负极上是金属铁失电子的过程,即Fe-2e-=Fe2+,故D错误.
故选A.
点评:本题考查学生原电池和电解池工作原理的应用以及电极反应式的书写等知识,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
相关题目
下列实验现象描述正确的是( )
| A、氯化氢与氨气相遇,有大量的白雾生成 |
| B、SO2通入品红溶液,红色褪去,再加热,红色不再出现 |
| C、SO2具有氧化性,可用于漂白纸浆 |
| D、用铂丝蘸取硫酸钠溶液灼烧,火焰呈黄色 |
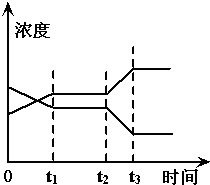 现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )| A、增大压强 |
| B、使用了催化剂 |
| C、升高温度 |
| D、减小了X或Y的浓度 |
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O Cl2→Cl-MnO4-→Mn2+ HNO3→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A、H2O2 |
| B、Cl2 |
| C、MnO4- |
| D、HNO3 |
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反应为:FePO4+Li
LiFePO4,含Li+导电固体为电解质.下列有关LiFePO4电池说法不正确的是( )
| 放电 |
| 充电 |
| A、可加入硫酸以提高电解质的导电性 |
| B、充电时LiFePO4既发生氧化反应又发生还原反应 |
| C、充电过程中,电池正极材料的质量减少 |
| D、放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
由CaCO3和MgCO3组的混和物充分加热至质量不再减少时,称得残留的固体质量是原混和物的一半,则残留物中钙、镁两元素原子的物质的量之比( )
| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol NaHSO4晶体中离子总数为3NA |
| B、2.24 L 14CH4分子中所含中子数为0.8NA |
| C、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| D、常温常压下,16gO2和O3混合气体含有NA个氧原子 |