题目内容
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O Cl2→Cl-MnO4-→Mn2+ HNO3→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A、H2O2 |
| B、Cl2 |
| C、MnO4- |
| D、HNO3 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:根据氧化还原反应中得失电子守恒的思想可知,在四个反应中氧化剂不一样,而还原剂均为碘化钾中的碘离子,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的也就是比较每1mol氧化剂得电子的多少,谁得电子多谁氧化的KI多,生成的I2就多.
解答:
解:由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
A、1molH2O2→H2O得2mole-,
B、1molCl2→2Cl-得2mole-,
C、1molMnO4-→Mn2+得5mole-,
D、1molHNO3→NO得3mole-;
显然C中1mol氧化剂得电子最多,生成的I2就最多,
故选C.
A、1molH2O2→H2O得2mole-,
B、1molCl2→2Cl-得2mole-,
C、1molMnO4-→Mn2+得5mole-,
D、1molHNO3→NO得3mole-;
显然C中1mol氧化剂得电子最多,生成的I2就最多,
故选C.
点评:本题综合考查氧化还原反应知识,侧重于氧化还原反应的计算,注意把握元素化合价的变化,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用镁铝合金制作的窗框、卷帘门、防护栏等物品轻巧、美观、耐用.与上述这些特点无关的镁铝合金的性质是( )
| A、不易生锈 | B、导电性好 |
| C、密度小 | D、强度高 |
100mL 6mol/L H2SO4跟过量锌粉反应,恒温下,为减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量某物质或溶液,其中不能达到目的是( )
| A、醋酸钠(固体) |
| B、水 |
| C、硫酸钾溶液 |
| D、硫酸铵(固体) |
某化学科研小组研究在其他条件不变时,改变某一条件对反应(可用aA(g)+bB(g)?cC(g)表示)的化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,?表示体积分数).根据图象,下列判断正确的是( )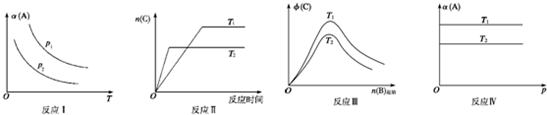

| A、反应Ⅰ:若p1>p2,则此反应只能在高温下自发进行 |
| B、反应Ⅱ:此反应的△H<0,且T1<T2 |
| C、反应III:△H>0且T2>T1或△H<0且T2<T1 |
| D、反应Ⅳ:T1<T2,则该反应不易自发进行 |
下列电极反应式正确的是( )
| A、氯碱工业电解饱和食盐水时,阳极电极反应式为 2Cl--2e-=Cl2↑ |
| B、精炼铜时,与电源正极相连的是纯铜,电极反应式为 Cu-2e-=Cu2+ |
| C、氢氧燃料电池的负极反应式 O2+2H2O+4e-=4OH- |
| D、钢铁发生电化腐蚀的正极反应式 Fe-2e-=Fe2+ |
下列反应中属于吸热反应的是( )
| A、Ba(OH)2?8H2O(s)+NH4Cl(s) |
| B、酸碱中和反应 |
| C、铝热反应 |
| D、实验室制取氢气的反应 |
下列表达式错误的是( )
A、甲基的电子式: |
B、碳原子的价电子轨道表示式: |
| C、硫离子的核外电子排布式:1s22s22p6 |
| D、碳-14原子:614C |
 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0