题目内容
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反应为:FePO4+Li
LiFePO4,含Li+导电固体为电解质.下列有关LiFePO4电池说法不正确的是( )
| 放电 |
| 充电 |
| A、可加入硫酸以提高电解质的导电性 |
| B、充电时LiFePO4既发生氧化反应又发生还原反应 |
| C、充电过程中,电池正极材料的质量减少 |
| D、放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该电池反应中,放电时,负极反应式为Li-e-=Li+,正极反应式为FePO4+Li++e-═LiFePO4,充电时,阳极、阴极电极反应式与原电池正负极电极反应式正好相反,据此分析解答.
解答:
解:A.Li能和稀硫酸反应,所以不能加入硫酸来提高电解质的导电性,故A错误;
B.充电时,该装置是电解池,LiFePO4既失电子又得电子,所以发生氧化反应又发生还原反应,故B正确;
C.充电过程中,阳极反应式为LiFePO4-e-=FePO4+Li+,所以电池正极材料质量减少,故C正确;
D.放电时电池正极反应为:FePO4+Li++e-═LiFePO4,故正确;
故选A.
B.充电时,该装置是电解池,LiFePO4既失电子又得电子,所以发生氧化反应又发生还原反应,故B正确;
C.充电过程中,阳极反应式为LiFePO4-e-=FePO4+Li+,所以电池正极材料质量减少,故C正确;
D.放电时电池正极反应为:FePO4+Li++e-═LiFePO4,故正确;
故选A.
点评:本题考查原电池和电解池原理,侧重考查电极反应式的书写及反应类型判断,明确物质的性质及各个电极上发生的反应即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( )
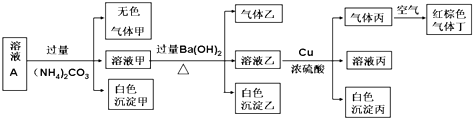

| A、沉淀乙一定有BaCO3,可能有BaSO4 |
| B、实验消耗Cu 14.4g,则生成气体丁的体积为3.36L |
| C、该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 |
| D、生成的甲、乙、丙气体均为无色的易溶于水气体 |
100mL 6mol/L H2SO4跟过量锌粉反应,恒温下,为减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量某物质或溶液,其中不能达到目的是( )
| A、醋酸钠(固体) |
| B、水 |
| C、硫酸钾溶液 |
| D、硫酸铵(固体) |
下列电极反应式正确的是( )
| A、氯碱工业电解饱和食盐水时,阳极电极反应式为 2Cl--2e-=Cl2↑ |
| B、精炼铜时,与电源正极相连的是纯铜,电极反应式为 Cu-2e-=Cu2+ |
| C、氢氧燃料电池的负极反应式 O2+2H2O+4e-=4OH- |
| D、钢铁发生电化腐蚀的正极反应式 Fe-2e-=Fe2+ |
下列说法不正确的是( )
| A、一个反应能否自发进行取决于该反应放热还是吸热 |
| B、同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| C、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| D、一个反应能否自发进行,与焓变和熵变的共同影响有关 |
下列反应中属于吸热反应的是( )
| A、Ba(OH)2?8H2O(s)+NH4Cl(s) |
| B、酸碱中和反应 |
| C、铝热反应 |
| D、实验室制取氢气的反应 |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe=3Fe2+ |
| D、FeCl2溶液跟Cl2反应:Fe2++Cl2=Fe3++2Cl- |
 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用